
【题目】如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。

(1)“O”点为什么不导电___________________。
(2)a、b、c三点的氢离子浓度由小到大的顺序为____________。
(3)a、b、c三点中,醋酸的电离程度最大的一点是_________。
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择__________。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水
E.加固体CH3COONa F.加Zn粒 G.加MgO固体 H.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是______________。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.c(H+)/c(CH3COOH)
【答案】冰醋酸未电离,无自由移动的离子 c<a<b c ACEFGH BD
【解析】
(1)冰醋酸在O点未能电离,不存在自由移动的离子,因此导电性为0;(2)溶液的导电性越强,溶液中氢离子浓度越大,所以a、b、c三点溶液的c(H+)由小到大的顺序是c<a<b;(3)醋酸是弱酸,存在电离平衡,稀释促进电离。所以a、b、c三点醋酸的电离程度最大的是c点;(4)A.加热促进醋酸电离,则溶液中醋酸根离子浓度增大,故正确;B.加很稀的NaOH溶液,促进醋酸电离,但溶液的体积增大,导致醋酸根离子浓度减小,故错误;C.加KOH固体,氢氧化钾和氢离子反应促进醋酸电离,所以醋酸根离子浓度增大,故正确;D.加水稀释能促进醋酸电离,但醋酸根离子浓度减小,故错误;E.加固体CH3COONa,能抑制醋酸电离,但醋酸钠电离出的醋酸根离子大于抑制醋酸电离出的醋酸根离子,所以醋酸根离子浓度增大,故正确;F.加入锌粒,和氢离子反应,促进醋酸电离,所以醋酸根离子浓度增大,故正确;G.加MgO固体和氢离子反应,促进醋酸电离,所以醋酸根离子浓度增大,故正确;H.加Na2CO3固体,和氢离子反应,促进醋酸电离,所以醋酸根离子浓度增大,故正确;答案选ACEFGH;(5)A.在稀释过程中,溶液的体积增大,氢离子的浓度减小,故A错误;B.弱电解质越稀,电离度越大,即电离出的氢离子数越多,故B正确;C.弱电解质越稀,电离度越大,平衡向右移动,CH3COOH分子数减少,故C错误;D.加水稀释,促进电离,n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,则c(H+)/c(CH3COOH)增大,故D正确;故答案为:BD。


科目:高中化学 来源: 题型:
【题目】以苯为原料合成一些化工产品的转化关系如下:

回答下列问题:
(1)A的名称是_________。
(2)C的结构简式为__________。
(3)B→D的反应类型是______;E中所含官能团名称是______。
(4)B→A的化学方程式为_________。
(5)写出E发生加聚反应方裎式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,以下是实验室制备精盐的实验方案:

(1)实验方案中②③④步通常采用以下三种试剂,a:Na2CO3溶液;b:BaCl2溶液;c:NaOH溶液,加入试剂不合理的顺序是(_____)
A.c b a
B.b c a
C.b a c
D.c a b
(2)如图是中学化学中常用于混合物的分离和提纯的装置,该实验方案中:

(1)在第⑤步操作中要用到的装置是图中的___(填字母),玻璃棒的作用是___;
(2)第⑦步操作的名称是___,所用到的实验装置是上图中的___(填字母),其中用于盛放溶液的仪器名称是___;
(3)检验SO42-是否除尽的操作方法是________;
(4)为提高精盐的产率,第⑤步操作后应对沉淀加以洗涤,请简要描述洗涤的方法是:___;
(5)写出第⑥步可能发生的化学反应方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是

A. 离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B. 元素W的最高价氧化物对应水化物的酸性比Q的强
C. 元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
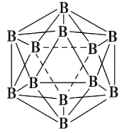
【题目】太阳能电池板材料除单晶硅外,还有氮、硼、硒、钛、钴、钙等元素组成的化学物质。
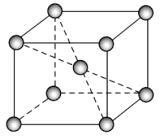
(1)钙原子基态时的电子排布式为___________,金属钴堆积方式与镁相似,都属于六方最密堆积,其配位数是___________。
(2)氮元素的第一电离能在同周期中(稀有气体除外)从大到小排第___________位;写出与NO3-互为等电子体的一种非极性分子的化学式___________。
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),其中有两个原子为10B,其余为11B,则该结构单元有___________种不同的结构类型。已知硼酸(H3BO3)为一元弱酸,解释其为一元弱酸的原因____________________________________________。硼酸的结构与石墨相似,层内的分子以氢键相连,含lmol硼酸的晶体中有___________mol氢键。
(4)硒是动物体必需的营养元素。SeO2是硒的重要化合物,SeO2的价层电子对互斥模型是___________。
(5)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为TiCl3·6H2O的晶体,该晶体中两种配体的物质的量之比为1︰5,则该配离子的化学式为___________。
(6)钴晶体的一种晶胞是一种体心立方结构(如图所示),若该晶胞的边长为am,密度为ρg/cm3,NA表示阿伏加德罗常数的值,则钴的相对原子质量可表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲元素位于元素周期表的第3周期II A族,乙元素的原子结构示意图为
①写乙元素的元素符号:___________。
②甲元素原子核外有_________个电子层。
③甲元素的金属性(即原子失电子的能力)比乙元素_________(填“强”或“弱”)。
(2)过氧化氢在适当条件下能发生分解反应:2H2O2 =2H2O+O2↑,现进行如下实验探究:在甲、乙两支大小相同的试管中各装入3mL 5%的过氧化氢溶液,再向其中的甲试管中加入少量MnO2粉末。请给合实验现象填写下列空白。
①实验目的:研究催化剂对过氧化氢分解反应速率的影响。
②实验现象:___________(选填“甲”或“乙”)试管中反应更剧烈,迅速放出无色气体。
③实验结论____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成水蒸气时放出121kJ的能量,且氧气中1molO=O键完全断裂时需要吸收496kJ的能量,水蒸气中1mol H-O键形成时放出463kJ的能量,则氢气中1mol H-H键断裂时吸收的能量为( )
A. 920kJB. 557kJC. 436kJD. 181kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,电池反应如下:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+2H2O,根据此反应判断下列叙述中正确的是( )
A.电池放电时,PbO2是负极;充电时,PbO2是电池的阳极
B.负极的电极反应式为:Pb+SO42﹣﹣2e﹣=PbSO4
C.放电时,PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)实验室制取Cl2的方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,其中MnO2发生了__反应,是__剂;每4分子氯化氢中只有___分子发生了___反应,盐酸是___剂。
MnCl2+Cl2↑+2H2O,其中MnO2发生了__反应,是__剂;每4分子氯化氢中只有___分子发生了___反应,盐酸是___剂。
(2)室温下KMnO4与浓盐酸反应制取氯气的化学方程式:2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑,请在上式中用单线桥法表示出不同元素的原子间得失电子的情况。___
(3)用CuCl2作催化剂,在450℃时用空气中的O2跟HCl反应也能制得氯气,其化学方程式:4HCl+O2![]() 2H2O+2Cl2,从氯元素化合价的变化看,以上三种制氯气方法的共同点是__;比较以上三个反应,可以认为氧化剂的氧化能力从强到弱的顺序为___。
2H2O+2Cl2,从氯元素化合价的变化看,以上三种制氯气方法的共同点是__;比较以上三个反应,可以认为氧化剂的氧化能力从强到弱的顺序为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com