
【题目】某学习小组为了探究CH3COOH的电离情况,进行了如下实验。
(实验一)测定醋酸溶液中CH3COOH的物质的量浓度。
用 0.2000mol/L 的 NaOH 溶液滴定 20.00mL 醋酸溶液,3 次滴定所消耗NaOH溶液的体积如下:
实验次数 | 1 | 2 | 3 |
消耗NaOH 溶液的体积/mL | 20.05 | 20.00 | 19.95 |
(1)量取 20.00 mL 醋酸溶液所用的仪器是_____(填字母)
|
|
|
|
a | b | c | d |
(2)以上醋酸溶液中CH3COOH的物质的量浓度为_____
(实验二)探究浓度对CH3COOH电离程度的影响。
用 pH 计测定 25℃时不同浓度的醋酸的 pH,结果如下:
浓度/(mol·L-1) | 0.2000 | 0.1000 | 0.0100 |
pH | 2.83 | 2.88 | 3.38 |
(3)根据表中数据可知CH3COOH是_____电解质(填“强”或“弱”) 得出此结论的依据是_____
(4)写出CH3COOH的电离方程式_____
【答案】c 0.2000mol/L 弱 c(CH3COOH)为0.1000mol/L时pH>1,即c(H+)<0.1000mol/L,说明CH3COOH未完全电离(或c(CH3COOH)由0.1000mol/L变为0.01mol/L时pH变化小于1,说明醋酸未完全电离)。 CH3COOH![]() CH3COOˉ+H+
CH3COOˉ+H+
【解析】
(1)醋酸溶液显酸性,所以量取20.00 mL醋酸溶液需要用酸式滴定管,所以选c;
(2)醋酸和NaOH的反应方程式为CH3COOH+NaOH=CH3COONa+H2O,消耗的NaOH溶液的平均体积为![]() =20.00mL,所以c(CH3COOH)=
=20.00mL,所以c(CH3COOH)=![]() =0.2000mol/L;
=0.2000mol/L;
(3)c(CH3COOH)为0.1000mol/L时pH>1,即c(H+)<0.1000mol/L,说明CH3COOH未完全电离,即醋酸为弱电解质。(或c(CH3COOH)由0.1000mol/L变为0.01mol/L时pH变化小于1,说明醋酸未完全电离);
(4)CH3COOH的电离方程式为CH3COOH![]() CH3COOˉ+H+。
CH3COOˉ+H+。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】用下列实验方案能达到实验目的的是
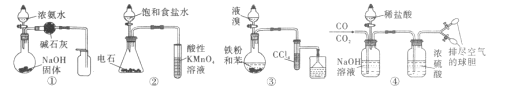
A.用图①的装置制取并收集干燥的NH3B.用图②的装置验证乙炔的还原性
C.用图③的装置制取溴苯D.用图④的装置分离CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3—>I-,氧化性IO3—>I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是( )

A.0~a间发生反应3HSO3—+IO3—===3SO42—+I-+3H+
B.a~b间共消耗NaHSO3的物质的量为1.2 mol
C.b~c间发生的反应中I2既是氧化产物又是还原产物
D.当溶液中I-与I2的物质的量之比为5∶2时,加入的KIO3为1.08 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A.漂白粉溶液中通入过量的CO2:Ca2+ +2ClO- + CO2 +H2O = CaCO3↓+2HClO
B.实验室用MnO2和浓盐酸制取Cl2:MnO2 + 4HCl(浓)![]() Mn2+ +2Cl- + Cl2↑ + 2H2O
Mn2+ +2Cl- + Cl2↑ + 2H2O
C.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3- + Ba2+ + OH-= BaCO3↓+ H2O
D.钠和冷水反应:Na + 2H2O = Na+ + H2↑+ 2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,错误的是
A.酸性:H2SO4>H3PO4
B.沸点:H2S>H2O
C.热稳定性:Na2CO3>NaHCO3
D.碱性:NaOH>Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是________;
(2)X电极发生的电极反应式为____________________;银电极上发生的电极反应为________(填“氧化”或“还原”)反应。
(3)外电路中的电子________(填“流出”或“流向”)Ag电极。
(4)当有3.2 g铜溶解时,银电极增重________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洁净安全的生存环境:2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视。
(1)煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是___(填化学式)。在煤中加入适量___,可以大大减少煤燃烧时SO2的排放,该反应的化学方程式为:___。
(2)A、B、C三个城市全年雨水的月平均pH变化如图所示。
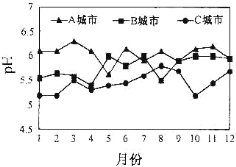
①受酸雨危害最严重的是___城市。
②汽车尾气中含有NO2、NO、CO等有害气体。汽车安装尾气净化装置可将NO、CO转化为无害气体。写出该反应的化学方程式:___。
③自来水生产过程中要经过:去除固体杂质和悬浮物、消毒、去除异味等一系净化工序。天然水中杂质较多,常需加入明矾,ClO2等物质处理后才能饮用:加入ClO2的作用是___;加入明矾后,Al3+水解生成的___(填化学式)胶体能吸附水中的悬浮颗粒,并使之沉降。
查看答案和解析>>
科目:高中化学 来源: 题型:
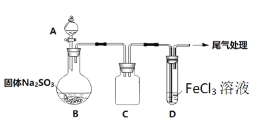
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,装置如下图所示。
已知:
i.Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
ii.生成Fe(HSO3)2+离子的反应为:Fe3+ +HSO![]() Fe(HSO3)2+ 。
Fe(HSO3)2+ 。
步骤一:实验准备:
如上图连接装置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和______,装置C的作用为:________________。
(2)用离子方程式解释1.0 mol·L-1 FeCl3溶液(未用盐酸酸化)pH=1的原因:________
步骤二:预测实验
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为:________________
步骤三:动手实验
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
①SO2与FeCl3溶液反应生成了Fe(HSO3)2+离子的实验证据为:__________。证明浅绿色溶液中含有Fe2+的实验操作为:_____________ 。
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
实验I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
实验II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
综合上述实验探究过程,得出的结论为:____________。
步骤四:反思实验:
(5)在制备SO2的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com