
【题目】用下列实验方案能达到实验目的的是
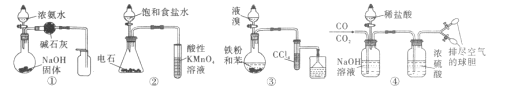
A.用图①的装置制取并收集干燥的NH3B.用图②的装置验证乙炔的还原性
C.用图③的装置制取溴苯D.用图④的装置分离CO和CO2
【答案】C
【解析】
A. 氨气的密度比空气密度小,图中氨气的收集方法不合理,应用向下排空气法收集,A项错误;
B. 乙炔及混有的硫化氢均使高锰酸钾褪色,由溶液褪色,不能说明乙炔的还原性,B项错误;
C. 苯和溴发生取代反应生成溴苯,四氯化碳可吸收挥发出的溴单质,烧杯中吸收尾气且防止倒吸,则图中装置可制备溴苯,C项正确;
D. 将CO、CO2混合气体通入氢氧化钠溶液中,CO2会与氢氧化钠反应生成碳酸钠,剩余的CO通过浓硫酸干燥,可将其收集在Y形管所连的上边的球胆中,再将稀盐酸滴入碳酸钠溶液中,可发生反应生成CO2,将其通过浓硫酸进行干燥,收集在下边的球胆中,但是稀盐酸易挥发,CO2中会混有HCl气体,则用图④的装置不能分离CO和CO2,可换用稀硫酸实现目的,D项错误;
答案选C。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
①CH3—CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2 L的庚烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
⑥能够快速、微量、精确地测定相对分子质量的物理方法是核磁共振谱法
A.①⑤⑥B.②③④C.③⑤⑥D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法正确的组合是( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
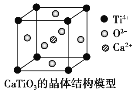
(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②④⑥B.①②③C.③⑤⑧D.③⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知p(A)=-lg c(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是( )
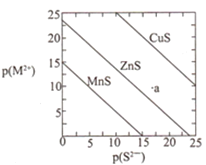
A.a点无ZnS沉淀生成
B.可用MnS除去MnCl2溶液中混有的少量ZnCl2
C.CuS和MnS共存的悬浊液中,c(Cu2+)/c(Mn2+)=10-20
D.向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c(S2-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌、硫化锌都是重要的基础化工原料。
(1)ZnO是两性氧化物,ZnO在NaOH溶液中转化成[Zn(OH)4]2-的离子方程式为_____________________________________________________。
(2)火法炼锌得到的氧化锌中含有铅、铜等杂质,提纯步骤如下:
![]()
反应Ⅰ ZnO(s)+CO(g) ![]() Zn(g)+CO2(g) △H1
Zn(g)+CO2(g) △H1
反应Ⅱ 2 Zn(g)+ O2(g)=2 ZnO(s) △H2
①上图中的“冷凝物”为________(填化学式)。
②某温度时,在反应Ⅰ的反应炉中,起始时c(CO)为0.3 molL-1,反应过程中CO2的体积分数φ(CO2)如图所示,则反应Ⅰ的平衡常数K=_______________。
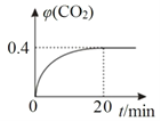
③下列措施有利于提高反应Ⅰ中 ZnO 转化率的是________。
a.增大ZnO的投料量 b.适当加压 c.将锌蒸气及时分离
④反应Ⅱ中,每转移 1 mol 电子,反应放热 174 kJ,则△H2=_____________。
(3)测定氧化锌样品纯度:称取0.5000 g样品,酸溶后定容于250 mL容量瓶中,摇匀。量取25.00 mL 该溶液,用0.04000 molL-1的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+(反应方程式为Zn2++H2Y2-=ZnY2-+2H+,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液15.12 mL。
①若滴定管未用 EDTA 标准液润洗,测定结果将__________(填“偏高”、“偏低”或“不变”)。
②样品纯度为___________(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如右图所示。下列叙述正确的是
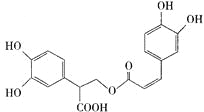
A.迷迭香酸的分子式为C18H15O8
B.迷迭香酸可以发生加成、取代、消去、显色反应
C.1mol迷迭香酸跟H2反应,最多消耗8mol H2
D.1mol迷迭香酸与足量NaOH溶液反应,最多消耗6mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学用一种标准盐酸去测定同一种未知浓度的NaOH溶液的浓度,但操作不同;甲把一定体积的NaOH溶液放入锥形瓶,把标准盐酸放入滴定管进行滴定;乙把一定体积的标准盐酸放入锥形瓶,把未知液NaOH溶液放入滴定管进行滴定。
(1)甲同学使用的是_______滴定管,乙同学使用的是________滴定管。
(2)甲同学的滴定管在用蒸馏水洗净后没有用标准盐酸润洗,乙同学的滴定管在用蒸馏水洗净后也没有用待测NaOH溶液润洗,其余操作均正确,这样甲同学测定结果________(偏大、偏小、无影响,下同),乙同学测定结果__________。
(3)乙同学选择酚酞作指示剂进行试验,如何来判断滴定终点:____________。
(4)甲同学根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据计算c(NaOH)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅作为一种新型能源被广泛开发利用,关于其有利因素下列说法中,你认为不正确的是( )
A.硅燃烧产物对环境产生的污染,容易得到有效控制
B.从Si(s)+O2(g)![]() SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
C.自然界中硅的贮存量丰富,可以从自然界直接获得单质硅
D.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组采用碘量法测定河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2![]() +I2 = 2I+
+I2 = 2I+![]() )。
)。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____。
(2)“氧的固定”中发生反应的化学方程式为___________。
(3)Na2S2O3能水解,则滴定时Na2S2O3溶液应装在_____(填下图中的仪器编号)。请补充润洗该仪器的操作方法:从滴定管____加入3~5mL所要盛装的溶液,__________,然后,一手控制活塞(酸式滴定管轻轻转动活塞;碱式滴定管轻轻挤压玻璃球),将液体从滴定管__放入预置的烧杯中。
甲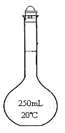 乙
乙 丙
丙![]() 丁
丁![]()
(4)某次滴定前滴定管液面如图所示,读数为________mL。
![]()
(5)量取100.00 mL水样经固氧、酸化后,从中取20.00 mL放入锥形瓶,用a mol·L1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为__mg·L1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com