
【题目】H2S溶液中,在采取措施使pH增大的同时,则c(S2﹣)的变化情况是( )
A.增大
B.减小
C.不变
D.可能增大,也可能减小
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( ) 
A.原子半径:Z>W>X>Y
B.气态氢化物的稳定性:Z>W>X>Y
C.W的最高正化合价与负化合价的绝对值不可能相等
D.Z的最高价氧化物的水化物可能为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
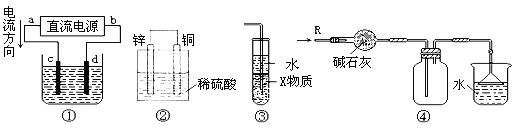
A. 若采用装置①铝件镀银,则c极为铝件,d极为纯银,电解质溶液为AgNO3溶液
B. 装置②是原电池,能将化学能转化为电能,SO42-移向锌电极
C. 装置③中X若为四氯化碳,用于吸收氨气或氯化氢,会引起倒吸
D. 装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b代表2种金属,下列叙述中,肯定能判断金属活动性a比b强的是( )
A. 常温下,a能从水中置换出氢,而b不能 B. 原子的电子层数a比b多
C. 原子的最外层电子数a比b少 D. 1 mol a 、b分别与足量盐酸反应,生成H2的质量a比b大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表是一座开放的“元素大厦”,元素大厦尚未客满。请你在元素大厦中为119号元素安排好它的房间( )
A. 第八周期第IA族 B. 第七周期第ⅦA族
C. 第七周期第0族 D. 第六周期ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯和乙醇蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为
A. 15.6% B. 26.7% C. 30% D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:
![]()
试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子方程式为_________________;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有__________、玻璃棒和烧杯等;步骤Ⅳ中最好应选用_______试剂调节溶液的pH(填字母编号)。
A.稀硝酸 B.氧化铜 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是_____________________;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是______________________;
(5)步骤Ⅵ中发生反应的化学反应方程式为_______________________________;
(6) 欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20mL 0.5mol/L的盐酸与一块大理石反应,下列措施不能提高反应速率的是 ( )
A. 加入10mL 1mol/L的盐酸 B. 加入30mL 10mol/L的盐酸
C. 加入10mL H2O D. 所用的大理石研磨成粉末
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com