
 �״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ش���������
�״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ش������������� ��1���ٴﵽ��ѧƽ��ʱ�����淴Ӧ������ȣ�������ֵ�Ũ�Ȳ�����ʱ��ı仯���仯�����ݻ�ѧƽ����������ɴ���������һϵ�������������䣬�ݴ����жϣ�
�ڻ�ѧ��Ӧ��ƽ�ⳣ�������¶ȵı仯���仯��
�۸��ݻ�ѧ��Ӧ����ʽ������ת����=$\frac{������}{��ʼ��}$��ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{c��CO��c��{H}_{2}��^{3}}$���㣻
��2����Һ��������Ǹ�����Һ��H+Ũ����OH-Ũ�ȵ���Դ�С�жϵģ�ֻҪ��Һ��c��H+��=c��OH-������Һ�ͳ����ԣ�HCOOH��������ʣ�����̶Ȳ���NaOH��ǿ����ʣ���ȫ���룬��Ӧ���ɵļ�������ǿ��������ˮ��ʼ��ԣ�����Һ�����ԣ����ټӼ������������Һ�������Һǡ����ȫ��Ӧʱ����Һ�Լ��ԣ����������ˮ��Ũ�ȼ�С��
��3�������������õ��ӺͶ�����̼��Ӧ����̼������Ӷ�������ԭ��Ӧ��
��4������ȼ���ȵĸ���д����Ӧ�Ȼ�ѧ����ʽ����ϸ�˹���������㻯ѧ��Ӧ���ʱ䣬Ȼ��д���Ȼ�ѧ����ʽ��
��� �⣺��1����A��ÿ����1molCO��ͬʱ����2molH2����֤�����淴Ӧ��������ȵģ���A����
B���÷�Ӧ��һ��ǰ������ϵ���ͱ仯�ķ�Ӧ����������������ʵ������䣬�ﵽ��ѧƽ��״̬����B����
C������CH3OH������������CO��������ȣ�����֤�����淴Ӧ��������ȵģ���ʱ��һ���ﵽ��ѧƽ�⣬��C��ȷ��
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯���ǻ�ѧƽ��״̬����������D����
�ʴ�Ϊ��C��
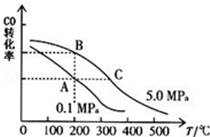
�ڸ���ͼ��CO��ƽ��ת���ʣ��������¶ȡ�ѹǿ�Ĺ�ϵ�����¶�����ʱ��һ����̼��ת������С�����Ի�ѧƽ�������ƶ�������ƽ�ⳣ����С����C���¶ȱ�B�ߣ�����K��B����K��C����
�ʴ�Ϊ������
�۽�2.0mol CO��6.0mol H2����2L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c��CO��=0.25mol/L����
CO��g��+2H2��g���TCH3OH��g��
��ʼŨ�ȣ�1.0 3.0 0
�仯Ũ�ȣ�0.75 1.5 0.75
ƽ��Ũ�ȣ�0.25 1.5 0.75
CO��ת����=$\frac{0.75mol/L}{1mol/L}$��100%=75%�����¶��µĻ�ѧƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{c��CO��c��{H}_{2}��^{3}}$=$\frac{0.75}{0.25��1��{5}^{2}}$��1.3��
�ʴ�Ϊ��75%��1.3��
��2��CH3COOH��������ʣ�����̶Ȳ���NaOH��ǿ����ʣ���ȫ���룬��Ӧ���ɵļ�������ǿ�������Σ�ˮ��ʼ��ԣ�����Һ������pH=7�����ټӼ���Գ����£���V mL��0.20mol•L-1����������Һ��μ��뵽20.00mL��0.20mol•L-1������Һ�У���ַ�Ӧ��V��20.00mL��Һ������pH=7��c��H+��=c��OH-����������������Һ�������Һǡ����ȫ��Ӧʱ����Һ�Լ��ԣ����������ˮ��Ũ�ȼ�С����Һ������Ũ�ȴ�С��ϵΪ��c��Na+����c��HCOO-����c��OH-����c��H+����
�ʴ�Ϊ������c��Na+����c��HCOO-����c��OH-����c��H+����
��3�������������õ��ӺͶ�����̼��Ӧ����̼������Ӷ�������ԭ��Ӧ���缫��ӦʽΪ��O2+4e-+2CO2=2CO32-��
�ʴ�Ϊ��O2+4e-+2CO2=2CO32-��
��4����H2��g����ȼ���ȡ�HΪ-285.8kJ•mol-1֪��1molH2��g����ȫȼ������1molH2O��l���ų�����285.8kJ��
����H2��g��+$\frac{1}{2}$O2��g��=H2O��l����H=-285.8kJ•mol-1��
CH3OH��H2��ȼ����Ϊ-726.5kJ/mol���õ�1mol�״���ȫȼ�����ɶ�����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
��CH3OH��l��+$\frac{1}{2}$O2��g��=CO2��g��+2 H2O��l����H=-726.5kJ•mol-1��
�ɸ�˹���ɿ�֪��3����-�ڵ�CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=-130.9 kJ•mol-1��
�ʴ�Ϊ��CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=-130.9 kJ/mol��
���� ���⿼���˻�ѧƽ��״̬���жϡ���ѧƽ���ƶ��Լ���ѧƽ�ⳣ��������Ũ�ȴ�С�Ƚϡ��缫����ʽ����д�ȣ���Ŀ�漰��֪ʶ��϶࣬�����ڿ���ѧ���Ի���֪ʶ���ۺ�Ӧ����������Ŀ�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ϩ | B�� | ��������춡�� | C�� | �Ҵ������� | D�� | �����Ǻ͵��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ζ���������ˮϴ�Ӻ�װ��NaOH��Һ���еζ� | |
| B�� | �ζ��ﵽ�յ�ʱ�����ֵζ��ܼ��첿�������Σ���ⶨ���ƫС | |
| C�� | �÷�̪��ָʾ��������ƿ����Һ�ɺ�ɫ����ɫʱֹͣ�ζ� | |
| D�� | ����NaOH��Һ�ĵ��룬��ƿ�е�pH��С��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4��1��5��NO2 | B�� | 4��2��4��NO2 | C�� | 4��1��3��NH4NO3 | D�� | 4��3��5��NO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���⻯ѧ�������������������ꡱ���γɶ��뵪���������й� | |
| B�� | SiO2������������ά���������ȶ���������ǿ�ᡢǿ�� | |
| C�� | ���ݷ�ɢ����ֱ����С���Խ���ɢϵ��Ϊ��Һ���������Һ | |
| D�� | ��������ͷ���ijЩ����Ԫ�ص����ʵı��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
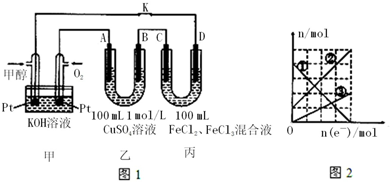
| A�� | �����ĵ缫��Ӧʽ�ǣ�CH3OH-6e-+8OH-�TCO32-+6H2O | |
| B�� | ����A�������������ڱ�״���µ����Ϊ1.12 L | |
| C�� | ��ͼ�Т��߱�ʾ����Fe2+���ӵı仯 | |
| D�� | ��Ӧ������Ҫʹ��װ����Һ�н���������ǡ����ȫ��������Ҫ280 mL 5.0 mol/L NaOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HO��CH2��2CHO | B�� | HO��CH2��2COOH | C�� | CH3CH2OH | D�� | CH3COOH |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com