
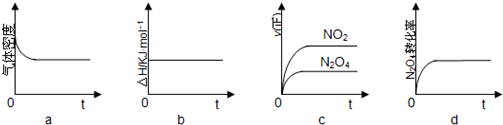
分析 (1)在氧化还原反应中化合价降低的反应物是氧化剂;
(2)升高温度,平衡向吸热反应方向移动;
(3)根据达到平衡状态,各组分浓度不变,正逆反应速率相等进行判断;化学平衡常数只与温度有关,与物质的浓度无关;根据v(NO2)=$\frac{△c}{△t}$计算NO2的化学反应速率,再根据同一反应中、同一时间段内反应速率之比等于计量数之比计算v(N2O4).
解答 解:(1)反应(Ⅰ)中,N2O4(l)中N元素得电子化合价降低,N2O4(l)是氧化剂,(CH3)2NNH2(l)中碳元素化合价升高,是还原剂,
故答案为:N2O4;
(2)升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应即△H>0,
故答案为:吸热;
(3)a、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c、根据反应速率大小,无法判断正逆反应速率是否相等,故c错误;
d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
化学平衡常数只与温度有关,与物质的浓度无关,所以平衡常数K不变,v(NO2)=$\frac{△c}{△t}$=$\frac{\frac{0.6mol}{1L}}{3s}$=0.2mol/L•s,则v(N2O4)=$\frac{1}{2}$v(NO2)=0.1mol/(L•s);
故答案为:ad;不变;0.1.
点评 本题考查了氧化剂的判断、化学反应速率的计算等知识点,注意化学平衡常数只与温度有关,与物质的浓度无关.


科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠可用作木材防火涂料 | B. | Fe2O3可用作外墙涂料 | ||
| C. | 过氧化钠可用作潜艇供氧剂 | D. | 铝制容器可以贮运稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
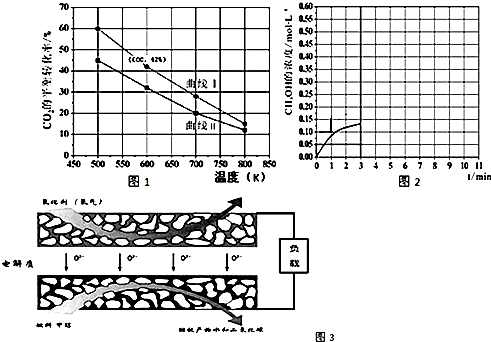
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
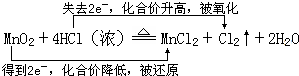
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
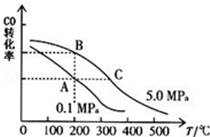 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉在氧气中燃烧生成Al2O3,故钠在氧气中燃烧生成Na2O | |
| B. | 铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜 | |
| C. | 活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中 | |
| D. | 钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属单质均作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 压强/106Pa | 1.01 | 2.02 | 40.4 |
| 平衡时c(A)/mol•L-1 | 0.022 | 0.05 | 0.075 |
| A. | ② | B. | ③④ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
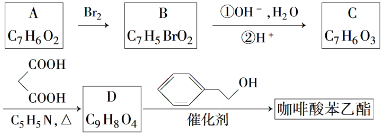
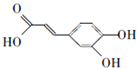 ;
;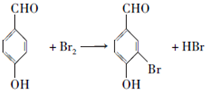 ;
;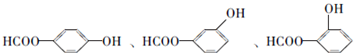 .a.属于酯类 b.能发生银镜反应 c.与FeCl3溶液发生显色反应①
.a.属于酯类 b.能发生银镜反应 c.与FeCl3溶液发生显色反应①查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com