

分析 (1)已知:①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③2H2(g)+O2(g)═2H2O(g)△H3
可利用盖斯定律将①+$\frac{1}{2}×$②-$\frac{1}{2}×$③计算CO(g)+2H2(g)═CH3OH(g) 的△H$\frac{△{H}_{2}-△{H}_{3}}{2}$;
(2)①由图象可知升高温度CO的转化率降低,说明平衡逆向移动;
②升高温度CO的转化率降低,曲线c转化来看最低,温度应最高,即为350℃,根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失;
③A.反应前后气体的物质的量不等,恒温、恒容条件下同,若容器内的压强不发生变化,可说明可逆反应达到平衡;
B.无论是否达到平衡状态,都存在H2的消耗速率是CO的消耗速率的2倍;
C.催化剂不能使平衡发生移动;
D.计算c(CO)以及剩余CO的物质的量,可计算转化率.
(3)平衡时氢气的浓度为0.5mol/L,v(H2)=$\frac{0.5mol/L}{2miqn}$=0.25mol•L-1•min-1,则v(CH3OH)=0.125mol•L-1•min-1,计算平衡浓度,可计算平衡常数,CO(g)+2H2(g)?CH3OH(g)的平衡常数是该反应的逆反应,体积不变的容器中,反应物与生成物全是气体,质量加倍,密度加倍.
解答 解:(1)已知:①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③2H2(g)+O2(g)═2H2O(g)△H3
则由①+$\frac{1}{2}×$②-$\frac{1}{2}×$③可得CO(g)+2H2(g)═CH3OH(g) 的△H=(△H1+$\frac{△{H}_{2}-△{H}_{3}}{2}$),
故答案为:△H1+$\frac{△{H}_{2}-△{H}_{3}}{2}$;
(2)①由图象可知升高温度CO的转化率降低,说明平衡逆向移动,则K减小,即K1>K2,故答案为:>;
②升高温度CO的转化率降低,曲线c转化来看最低,温度应最高,即为350℃,根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失,
故答案为:350;在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失;
③A.反应前后气体的物质的量不等,恒温、恒容条件下同,若容器内的压强不发生变化,可说明可逆反应达到平衡,故A正确;
B.无论是否达到平衡状态,都存在H2的消耗速率是CO的消耗速率的2倍,不能判断是否达到平衡状态,故B错误;
C.使用合适的催化剂能缩短达到平衡的时间,但不能使平衡发生移动,故C错误;
D.某温度下,将2molCO和6molH2充入2L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则剩余0.4molCO,则CO的转化率为$\frac{2mol-0.4mol}{2mol}×100%$=80%,故D正确.
故答案为:AD;
(3)平衡时氢气的浓度为0.5mol/L,v(H2)=$\frac{0.5mol/L}{2miqn}$=0.25mol•L-1•min-1,则v(CH3OH)=0.125mol•L-1•min-1,
CH3OH(g)?CO(g)+2H2(g)
反应前浓度(mol/L )0.5 0 0
反应的浓度(mol/L )0.25 0.25 0.5
反应的浓度(mol/L )0.25 0.25 0.5
代入公式K=$\frac{0.5×0.5×0.25}{0.25}$=0.25,求得该反应的化学平衡常数为0.25(mol•L)2.
CO(g)+2H2(g)?CH3OH(g)的平衡常数是该反应的逆反应,所以系数是其倒数,应为4,
体积不变的容器中,反应物与生成物全是气体,质量加倍,故密度加倍,
故答案为:0.125mol•L-1•min-1; 4 L2•mol-2; D.
点评 本题考查化学平衡计算与影响因素、平衡常数、化学反应速率计算及影响因素、化学平衡图象等,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意理解掌握平衡移动原理,难度中等.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.65g | B. | 7.3g | C. | 10.95g | D. | 14.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
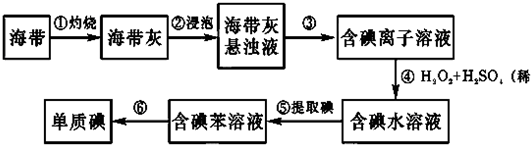
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
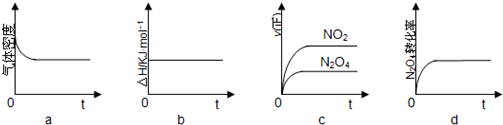
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若W为有颜色的物质,达平衡后,增大压强,体系颜色变浅 | |
| B. | 改变压强,该反应的平衡常数不变 | |
| C. | 平衡时,其他条件不变,升高温度,正反应速率增大程度比逆反应速率增大程度小 | |
| D. | 平衡时,其他条件不变,分离出 Z,正反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
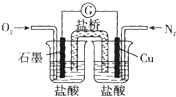
| A. | 石墨的电极反应:O2+2H20+4e-═4OH- | |
| B. | 此装置能将化学能转变为电能 | |
| C. | 电子由Cu电极经导线流向石墨电极 | |
| D. | 电池总反应:2Cu+O2+4HCl═2CuCl2+2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
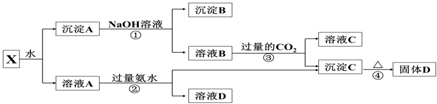
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com