
| A. | 标准状况下.22.4L水含有NA个水分子 | |
| B. | 1mol/LNa2C03溶液中含有Na+数目为2NA | |
| C. | 常温常压下,22.4L02中含有2NA个氧原子 | |
| D. | 169O2和O3的混合气体中含氧原子数目为NA |
分析 A.气体摩尔体积使用对象为气体;
B.溶液体积未知;
C.常温常压下,Vm>22.4L/mol;
D.氧气和臭氧都是由氧原子构成,依据n=$\frac{m}{M}$计算.
解答 解:A.标况下水是液体,不能使用气体摩尔体积,故A错误;
B.溶液体积未知,依据n=CV可知,无法计算钠离子个数,故B错误;
C.常温常压下,Vm>22.4L/mol,22.4L02中物质的量小于1mol,含有小于2NA个氧原子,故C错误;
D.16gO2和O3的混合气体中含氧原子数目为$\frac{16g}{16g/mol}$×NA=NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
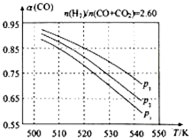 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 物质 | CO | CO2 | H2 | CH3OH(g) |
| 标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热的反应发生时不必加热 | |
| B. | 反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 放热反应在常温下一定很容易发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 75mL 2mol•L-1氯化镁溶液 | B. | 150mLl 1 mol•L-1氯化钠溶液 | ||
| C. | 50mL3mol•L-1氯化钾溶液 | D. | 50mL 1 mol•L-1氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v (A)=0.36mol•L-1•s-1 | B. | v (B)=0.55mol•L-1•s-1 | ||
| C. | v (C)=0.40mol•L-1•s-1 | D. | v (D)=0.48mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,能与NaOH溶液反应生成盐和水 | |
| B. | 实验室中用石灰水区分Na2CO3与NaHCO3两瓶无标签溶液 | |
| C. | O3和O2为同种元素组成的单质,所以O3和O2互为同位素 | |
| D. | Na2O和Na2O2组成元素相同,与H2O的反应产物也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO21 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com