
【题目】物质的量相同的下列各物质,分别在足量的O2中完全燃烧,其中耗氧量相同的一项是
A.CH3OH和C3H6B.C3H7COOH和
C.C2H5CHO和C3H4D.C3H8和C4H6
【答案】C
【解析】
设有机物通式为CxHyOz,消耗氧气的物质的量为(x+![]() -
-![]() ),有机物无论它们以何种物质的量的比例混和,只要总物质的量一定,则在完全燃烧时,消耗氧气的量相同,即(x+
),有机物无论它们以何种物质的量的比例混和,只要总物质的量一定,则在完全燃烧时,消耗氧气的量相同,即(x+![]() -
-![]() )相等,据此计算判断。
)相等,据此计算判断。
A.CH3OH 和C3H6耗氧量分别为1+1-0.5=1.5和3+1.5=4.5,耗氧量不相同,故A错误;
B.C3H7COOH 和C2H5COCH3耗氧量分别为4+2-1=5和4+2-0.5=5.5,耗氧量不相同,故B错误;
C.C2H5CHO的消耗氧的量为3+1.5-0.5=4,而C3H4耗氧量是3+1=4,两者耗氧量相同,故C正确;
D.C3H8 和C4H6耗氧量分别为3+2=5和4+1.5=5.5,耗氧量不相同,故D错误;
故选C。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等。已知:饱和NaClO2溶液在温度低于38℃时析出NaCO23H2O晶体,温度高于38℃时析出NaClO2晶体,温度高于60℃时,NaClO2分解生成NaClO3和NaCl。其生产工艺如图所示。
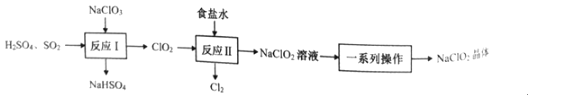
回答下列问题:
(1)NaClO2中氯元素的化合价为__。
(2)“反应Ⅰ”中氧化剂与还原剂的物质的量之比为__。
(3)“反应”所用“食盐水”由粗盐水精制而成。精制时,为除去粗盐水中的Ca2+、Mg2+和SO42-,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是__。(填标号)
A.①②③④
B.②①③④
C.③①②④
D.③②①④
(4)“一系列操作”为蒸发浓缩、趁热过滤、__、干燥,其中“趁热过滤”应控制的温度范围是__。
(5)“反应Ⅱ”产生的Cl2可用于制备含氯消毒剂。将Cl2通入足量NaOH溶液中,加热后得到NaCl、NaCIO、NaClO3的混合液。经测定ClO-与ClO3-的物质的量浓度之比为3:1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。已知SO2Cl2的熔点为-54.1℃,沸点为69. 1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
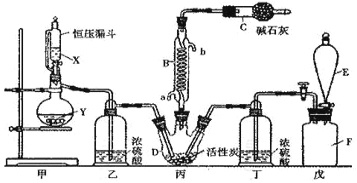
(1)仪器E的名称是_____________,由B的使用可知SO2与氯气之间的反应属于______(填“放”或“吸”)热反应,B处反应管冷却水应从____________ (填“a”或“b”)接口通入。如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是_______________________________________。
(2)试剂X、Y的组合最好是_________。
a.98%硫酸和铜 b.稀硝酸和亚硫酸钠固体 c.60%硫酸和亚硫酸钾固体
(3)戊是贮气装置,则E中的试剂是_________;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是___________________________.
(4)取1.00g蒸馏后的液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.50g,则所得馏分中二氯化砜的质量百分含量为___________ %(结果保留小数点后1位)。
(5)二氯化砜应储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是_______________________________。
Ⅱ.乙同学设计了一套电解饱和食盐水的实验装置,来验证氯气的某些性质和测定产生的氢气的体积。
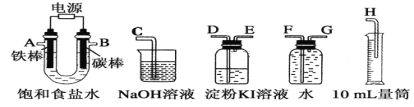
(1)所选仪器接口的连接顺序是A接________,________接________;B接________,________接________。
(2)若装入的饱和食盐水为100mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为112mL(标准状况下)时停止通电。将U形管内的溶液倒入烧杯,常温时测得溶液的pH约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A 是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
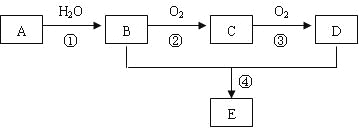
请回答下列问题:
(1)写出A的结构简式___________________________。
(2)B、C分子中的官能团名称分别是________________、______________________。
(3)写出与E具有相同官能团的D的同分异构体的结构简式_______________________。
(4)写出下列反应的化学方程式:
①__________________________________________;反应类型:____________。
④_________________________________________;反应类型:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含![]() 、
、![]() 、
、![]() 及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
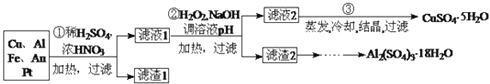
回答下列问题:
![]() 第
第![]() 步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
![]() 第
第![]() 步加入
步加入![]() 的作用是 ______ ,使用
的作用是 ______ ,使用![]() 的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
![]() 由滤渣2制取
由滤渣2制取![]() ,探究小组设计了三种方案:
,探究小组设计了三种方案:
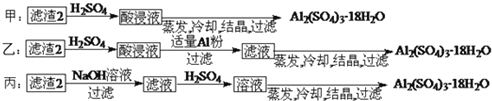
上述三种方案中, ______ 方案不可行,原因是 ______ ;
![]() 探究小组用滴定法测定
探究小组用滴定法测定![]() 含量.取ag试样配成100mL溶液,每次取
含量.取ag试样配成100mL溶液,每次取![]() ,消除干扰离子后,用c
,消除干扰离子后,用c![]()
![]() 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b![]() 滴定反应如下:
滴定反应如下:![]() 写出计算
写出计算![]() 质量分数的表达式
质量分数的表达式![]() ______ .
______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题小组合成了一种复合材料的基体M的结构简式为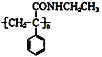 ,合成路线如下
,合成路线如下
![]()
已知:R—CN![]() R—COOH
R—COOH
请回答下列问题:
![]() 有机物C分子结构中含有的官能团有______________。
有机物C分子结构中含有的官能团有______________。
![]() 写出A的结构简式 _________________。
写出A的结构简式 _________________。
![]() 反应①、②的反应类型分别为 _______________、 ________________。
反应①、②的反应类型分别为 _______________、 ________________。
![]() 写出反应③的化学方程式 ________________。
写出反应③的化学方程式 ________________。
![]() 写出符合下列条件:①能使
写出符合下列条件:①能使![]() 溶液显紫色;②只有二个取代基;③与新制的
溶液显紫色;②只有二个取代基;③与新制的![]() 悬浊液混合加热,有砖红色沉淀生成;有机物B的一种同分异构体的结构简式 _____________。
悬浊液混合加热,有砖红色沉淀生成;有机物B的一种同分异构体的结构简式 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是

A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用原电池原理可以处理硫酸工业产生的SO2尾气。现将SO2 通入如图装置(电极均为惰性材料)进行实验。下列说法不正确的是
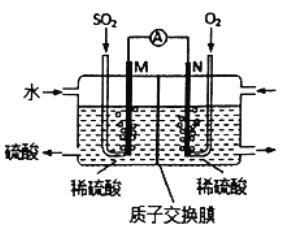
A. M极为负极,电极上发生氧化反应
B. 溶液中H+移向N区,SO42-移向M区
C. N极发生的电极反应为O2+4H++4e-=2H2O
D. 相同条件下,M、N两极上消耗的气体体积之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃、101kPa条件下,由H2、CH4组成的混合气体amL,通入一定量(设为xmL)氧气使其完全燃烧。
(1)若amL混合气体完全燃烧消耗相同条件下氧气的体积也为amL(即x=a),则原混合气体中CH4的体积分数是_____(保留三位有效数字);
(2)若原混合气体完全燃烧时,生成的气体中只有CO2和H2O(g),则x的取值范围是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com