
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等。已知:饱和NaClO2溶液在温度低于38℃时析出NaCO23H2O晶体,温度高于38℃时析出NaClO2晶体,温度高于60℃时,NaClO2分解生成NaClO3和NaCl。其生产工艺如图所示。
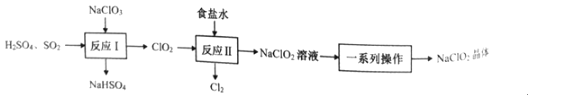
回答下列问题:
(1)NaClO2中氯元素的化合价为__。
(2)“反应Ⅰ”中氧化剂与还原剂的物质的量之比为__。
(3)“反应”所用“食盐水”由粗盐水精制而成。精制时,为除去粗盐水中的Ca2+、Mg2+和SO42-,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是__。(填标号)
A.①②③④
B.②①③④
C.③①②④
D.③②①④
(4)“一系列操作”为蒸发浓缩、趁热过滤、__、干燥,其中“趁热过滤”应控制的温度范围是__。
(5)“反应Ⅱ”产生的Cl2可用于制备含氯消毒剂。将Cl2通入足量NaOH溶液中,加热后得到NaCl、NaCIO、NaClO3的混合液。经测定ClO-与ClO3-的物质的量浓度之比为3:1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为__。
【答案】+3 2:1 C 洗涤 大于38℃小于60℃ 1:2
【解析】
(1)根据化合价代数和等于0计算NaClO2中氯元素的化合价;
(2)“反应Ⅰ”是氯酸钠、二氧化硫、硫酸反应生成硫酸氢钠、二氧化氯;
(3)食盐精制时,加NaOH溶液除去Mg2+;加 Na2CO3溶液除去Ca2+、Ba2+;加BaCl2溶液除去SO42-;过滤后加稀盐酸除去CO32-、OH-;
(4)晶体需要洗涤后干燥;温度高于38℃时析出NaClO2晶体,温度高于60℃时,NaClO2分解生成NaClO3和NaCl;
(5)根据得失电子守恒计算被氧化的氯元素与被还原的氯元素的物质的量之比;
(1)NaClO2中钠元素化合价为+1、氧元素化合价为-2,根据化合价代数和等于0,氯元素的化合价为+3;
(2)“反应Ⅰ”是氯酸钠、二氧化硫、硫酸反应生成硫酸氢钠、二氧化氯,根据得失电子守恒配平方程式为2NaClO3+SO2+H2SO4= 2NaHSO4+2ClO2,硫元素化合价升高,SO2是还原剂,氯元素化合价降低,NaClO3是氧化剂,氧化剂与还原剂的物质的量之比为2:1;
(3)精制食盐时,加NaOH溶液除去Mg2+;加 Na2CO3溶液除去Ca2+、Ba2+;加BaCl2溶液除去SO42-;过滤后加稀盐酸除去CO32-、OH-;所以加入氯化钡后再加碳酸钠,加试剂的顺序是③①②④,故选C。
(4)“一系列操作”为蒸发浓缩、趁热过滤、洗涤、干燥;温度高于38℃时析出NaClO2晶体,温度高于60℃时,NaClO2分解生成NaClO3和NaCl,所以“趁热过滤”应控制的温度范围是大于38℃小于60℃;
(5)Cl2通入足量NaOH溶液中,加热后得到NaCl、NaCIO、NaClO3的物质的量比为x:3:1,根据得失电子守恒,x×(-1)+3×1+1×5=0,解得x=8,被氧化的氯元素与被还原的氯元素的物质的量之比1:2。


科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:

请回答下列问题:
(1)写出实验流程中下列物质的化学式:
试剂X :______________ 沉淀A:______________ 沉淀B:________________。
(2)上述实验流程中加入过量的Na2CO3的目的是____________________________。
(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业中的用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O;
②气体液化的温度:NO2为21 ℃,NO为-152 ℃。
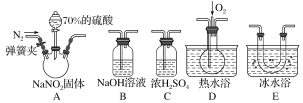
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、________、________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是________________________________________________________________________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是________________________。
②装置E的作用是_________________________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为___________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁溶液可腐蚀印刷电路板上的铜膜,某小组为了从腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为溶液作为腐蚀液原料循环使用,设计了如下实验步骤:
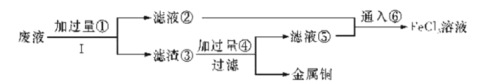
(1)写出下列物质的化学式①___、⑥___。
(2)步骤Ⅰ的操作名称:___。
(3)写出FeCl3溶液与铜发生反应的离子方程式:_______。
(4)向②中加入NaOH溶液并长时间暴露在空气中,先产生白色沉淀,后迅速变为灰绿色,接着又转化为__色沉淀,此过程所涉及反应的化学方程式为:______、___。
(5)通入⑥发生反应的离子方程式:________。
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是___(填字母代号)。
A 有铜无铁 B 有铁无铜 C 铁、铜都有 D 铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,分别向20.00 mL 0.100 0 mol·L-1的氨水、醋酸铵溶液中滴加0.100 0 mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是( )
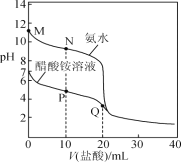
A.M点溶液中:c(OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B.N点溶液中:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)
C.P点溶液中: c(NH4+)+c(NH3·H2O)<c(CH3COO-) +c(CH3COOH)
D.Q点溶液中:2c(Cl-)=c(CH3COOH)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应物按所给物质的量配比进行反应,其中固体完全反应的是( )
A.n(Cu):n(HNO3浓)=1:4B.n(Fe):n(HNO3浓)=1:2
C.n(C):n(H2SO4浓)=1:2D.n(MnO2):n(HCl浓)=1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行实验,不能达到相应实验目的的是( )
A.利用装置①分离Fe(OH)3胶体和FeCl3溶液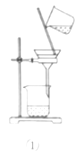
B.利用装置②干燥、收集氨气并吸收多余的氨气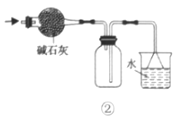
C.利用装置③收集NO2气体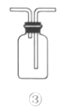
D.利用装置④证明Cl2易与NaOH溶液反应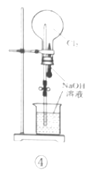
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化法制硝酸是工业生产硝酸的主要途径,某同学利用该原理在实验室探究硝酸的制备和性质,设计了如图所示装置。
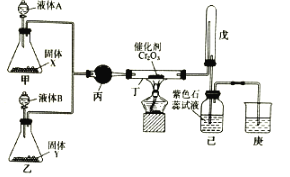
回答下列问题:
(1)甲、乙两装置分别制取氨气和氧气。盛装液体A、B的仪器名称为__。若固体X是NaOH,则液体A为__(填名称);若Y是淡黄色固体、B为纯净物,则液体B为__(填化学式);若固体Y是MnO2,则液体B为__(填化学式)。
(2)丁中发生反应的化学方程式为__。
(3)装置戊的作用是__。
(4)为防止过量的氨气影响硝酸的制备和性质实验,可在丁、戊之间添加一个U型干燥管,其中盛装的试剂可以是下列中的__。(填标号)
A.碱石灰
B.生石灰
C.浓硫酸
D.无水氯化钙
(5)改装后,实验中观察到戊装置中的气体变为红棕色,己瓶中溶液颜色变红。若通入到己瓶中的红棕色混合气体恰好与水完全反应且无其他气体生成,则己瓶中发生反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量相同的下列各物质,分别在足量的O2中完全燃烧,其中耗氧量相同的一项是
A.CH3OH和C3H6B.C3H7COOH和
C.C2H5CHO和C3H4D.C3H8和C4H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com