【答案】
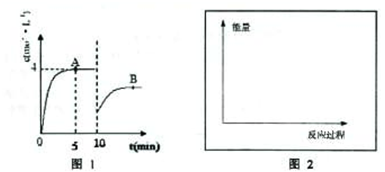
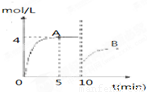
分析:(1)由图可知,反应到5min时达平衡状态,氨气的浓度为4mol/L,根据v=
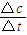
计算v(NH
3),再利用速率之比等于化学计量数之比计算v(H
2);
根据三段式计算平衡时各组分的浓度,代入平衡常数k=
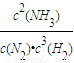
计算;
(2)由图可知,10min瞬间改变条件,NH
3的浓度为原平衡的一半,随后氨气的浓度增大,改变条件平衡向生成氨气的方向移动,应该是移走氨气的物质的量,降低氨气的浓度;
(3)电离平衡常数只受温度影响,温度不变,电离平衡常数不变,离子浓度无关;
(4)反应前后气体的体积发生变化,恒温恒容下,加入2mol C
3,按化学计量数转化到左边,可得到2molA
2(g)、1molB
2(g),与开始加入2mol A
2和1mol B
2为等效平衡,平衡时对应组分的物质的量相等,令平衡时容器内C
3的物质的量为xmol,根据方程式计算两种状态到达平衡时参加反应的A
2、C
3物质的量,在根据热化学方程式计算热量,据此计算解答.
解答:解:(1)由图可知,反应到5min时达平衡状态,氨气的浓度为4mol/L,故v(NH
3)=
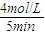
=0.8mol/(L?min),速率之比等于化学计量数之比,
故v(H
2)=

v(NH
3)=

×0.8mol/(L?min)=1.2mol/(L?min),
N
2+3H
2?2NH
3,
开始(mol/L):a b 0
变化(mol/L):2 6 4
平衡(mol/L):a-2 b-6 4
故平衡常数k=
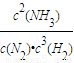
=
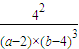
=
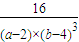
故答案为:1.2mol/(L?min);
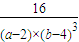
;
(2)由图可知,10min瞬间改变条件,NH
3的浓度为原平衡的一半,随后氨气的浓度增大,改变条件平衡向生成氨气的方向移动,应该是移走氨气的物质的量,降低氨气的浓度,
故答案为:移走生成的氨气,降低氨气的浓度;
(3)电离平衡常数只受温度影响,温度不变,电离平衡常数不变,离子浓度无关,故答案为:=;
(4)反应前后气体的体积发生变化,恒温恒容下,加入2mol C
3,按化学计量数转化到左边,可得到2molA
2(g)、1molB
2(g),与开始加入2mol A
2和1mol B
2为等效平衡,平衡时对应组分的物质的量相等,令平衡时容器内C
3的物质的量为xmol,则:
对于开始加入2mol A
2和1mol B
2,根据2A
2(g)+B
2(g)═2C
3(g)可知,参加反应的A
2的物质的量为xmol,故放出的热量为akJ×
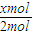
=0.5axkJ,即b=0.5ax,
对于只加入2mol C
3,由反应2C
3(g)?2A
2(g)+B
2(g),参加反应的C
3的物质的量为(2-x)mol,故该反应吸收的热量为akJ×
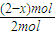
=(1-0.5x)akJ,即c=(1-0.5x)a,
故b+c=a,
故答案为:b+c=a.
点评:本题考查化学反应速率计算、平衡常数有关计算与影响因素、化学平衡图象与影响因素、等效平衡、反应热的有关计算等,题目综合性较大,难度中等,注意(4)中对于同一可逆反应,在相同温度下,正逆反应的反应热数值相等,符号相反.

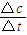 计算v(NH3),再利用速率之比等于化学计量数之比计算v(H2);
计算v(NH3),再利用速率之比等于化学计量数之比计算v(H2);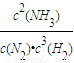 计算;
计算;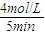 =0.8mol/(L?min),速率之比等于化学计量数之比,
=0.8mol/(L?min),速率之比等于化学计量数之比, v(NH3)=
v(NH3)= ×0.8mol/(L?min)=1.2mol/(L?min),
×0.8mol/(L?min)=1.2mol/(L?min),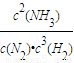 =
=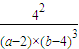 =
=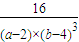
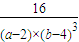 ;
;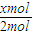 =0.5axkJ,即b=0.5ax,
=0.5axkJ,即b=0.5ax,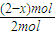 =(1-0.5x)akJ,即c=(1-0.5x)a,
=(1-0.5x)akJ,即c=(1-0.5x)a,