

分析 (1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
(2)装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平书写方程式;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、低温干燥的方法,注意温度控制;
(4)反应结束时,由于ClO2和SO2有毒,所以要打开K1,用氢氧化钠溶液吸收,高于60℃时NaClO2分解成NaClO3和NaCl;
(5)根据化学反应可得关系式:NaClO2~2I2~4S2O32-,令样品中NaClO2的物质的量x,根据关系式计算.
解答 解:(1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,
故答案为:防止D瓶溶液倒吸到B瓶中;
(2)装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,
故答案为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:趁热过滤;60;
(4)反应结束时,由于ClO2和SO2有毒,所以要打开K1,用氢氧化钠溶液吸收,由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3,
故答案为:吸收装置B中多余的ClO2和SO2,防止污染空气;NaClO3;
(5)令样品中NaClO2的物质的量x,
NaClO2~2I2~4S2O32-,
1mol 4mol
0.25x c mol•L-1×V×10-3L
则:x=c•V•10-3mol
故答案为:c•V•10-3mol.
点评 本题考查制备方案的设计与评价,题目难度中等,涉及亚氯酸钠制备实验的基本操作、亚氯酸钠的性质及中和滴定等知识,理解实验原理是解题的关键,试题侧重考查学生的分析理解能力及灵活应用能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
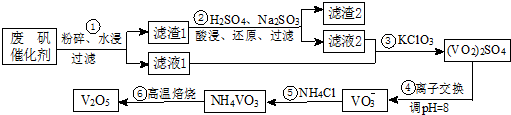
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
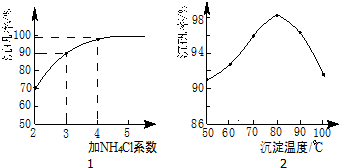
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4甲基4,5二乙基己烷 | B. | 2,3-二甲基-2,4-戊二烯 | ||
| C. | CH3CH(OH)CH2CH3:丁醇 | D. | 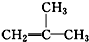 :2-甲基-1-丙烯 :2-甲基-1-丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

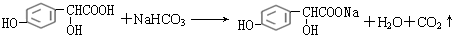 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com