
分析 (1)中和热测定实验成败的关键是保温工作;
(2)为了保证HCl完全反应,碱应过量;温度过低,散热加快,对实验结过造成的误差较大;
(3)先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)根据弱电解质电离吸热分析.
解答 解:(1)大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失;
故答案为:保温、隔热、减少实验过程中的热量散失;
(2)NaOH的浓度大于HCl的浓度,使盐酸完全被中和;当室温低于10℃时进行,散热加快,对实验结过造成的误差较大;
故答案为:使盐酸完全被中和,减少了盐酸挥发对实验的影响;如果温度过低,散热加快,对实验结过造成的误差较大;
(3)0.50mol•L-1HCl和0.55mol•L-1的NaOH溶液各50mL进行中和反应,生成水的物质的量为:0.05L×0.50mol•L-1=0.025mol,溶液的质量为:100ml×1g/ml=100g,设反应前后的温度值分别用t1和t2表示,温度变化的值△T=t2-t1,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×(t2-t1)=0.418(t2-t1)kJ;所以实验测得的中和热为:△H=-$\frac{0.418(t2-t1)}{0.025}$kJ/mol;
故答案为:0.418(t2-t1);-$\frac{0.418(t2-t1)}{0.025}$kJ/mol;
(4)反应放出的热量和所用酸以及碱的量的多少有关,用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,测得中和热数值相等;
故答案为:相等;不相等;
(5)醋酸为弱酸,电离过程为吸热过程,所以用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液,反应放出的热量偏小,故答案为:偏小.
点评 本题主要考查学生有关中和热的测定知识,可以根据所学知识进行回答,注意对中和热概念的理解,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.0摩尔 | B. | 1.6摩尔 | C. | 2.2摩尔 | D. | 2.0摩尔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
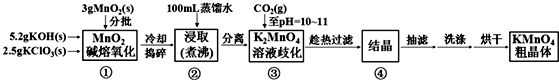
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 物质燃烧不一定是放热反应 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 吸热反应不加热就不会发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com