
分析 有A、B、C、D四种化合物,分别由K+、Ba2+、SO42-、CO32-、SO32-、OH-组成,
①A不溶于水和盐酸,应为硫酸钡;
②B不溶于水但溶于盐酸,并放出无气味的气体,该气体可使澄清石灰水变浑浊,可知是BaCO3;
③C的水溶液呈碱性,与硫酸反应生成A,依据A为BaSO4分析,C为Ba(OH)2;
④D可溶于水,与H2SO4作用时放出气体E,E可使溴水褪色,D为K2SO3,以此解答该题.
解答 解:有A、B、C、D四种化合物,分别由K+、Ba2+、SO42-、CO32-、SO32-、OH-组成,
①A不溶于水和盐酸,应为硫酸钡;
②B不溶于水但溶于盐酸,并放出无气味的气体,该气体可使澄清石灰水变浑浊,可知是BaCO3;
③C的水溶液呈碱性,与硫酸反应生成A,依据A为BaSO4分析,C为Ba(OH)2;
④D可溶于水,与H2SO4作用时放出气体E,E可使溴水褪色,D为K2SO3,
(1)上述推断得到A为BaSO4,B为BaCO3,C为Ba(OH)2 ,D为K2SO3,E为CO2,故答案为:BaSO4;BaCO3;Ba(OH)2;K2SO3;CO2;
(2)B与盐酸反应是BaCO3和盐酸反应生成氯化钡和水,反应的离子方程式为:2H++BaCO3=CO2↑+H2O+Ba2+,
C和硫酸反应是Ba(OH)2和硫酸反应生成硫酸钡和水,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,
D与硫酸反应是K2SO3和硫酸反应生成二氧化碳和水,反应的离子方程式为:SO32-+2H+═H20+SO2↑,
E(少量)与溴水反应生成氢溴酸和硫酸,反应的离子方程式为:2H20+SO2+Br2═4H++2 Br--+SO42-,
故答案为:2H++BaCO3=CO2↑+H2O+Ba2+;Ba2++2H++2OH-+SO42-=BaSO4↓+2H2O;SO32-+2H+═H20+SO2↑;2H20+SO2+Br2═4H++2 Br--+SO42-.
点评 本题考查了物质推断,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质性质和反应现象的分析判断,物质检验实验方法分析,实验过程中反应现象的理解应用,物质和离子性质熟练掌握是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
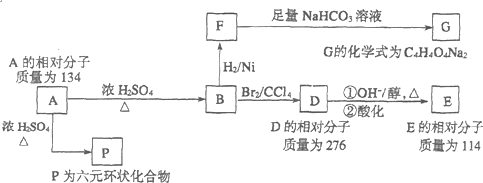
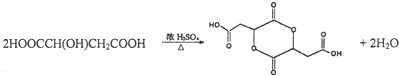 .
.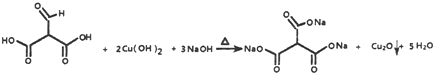 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

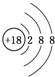 .元素K名称为氯在周期表中的位置第三周期第ⅦA族.
.元素K名称为氯在周期表中的位置第三周期第ⅦA族.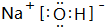
 HClO+HCl.
HClO+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
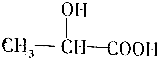 ,
,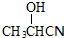 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 实验目的 | T/K | Fe/g | c(H2SO4)/mol•L-1 |
| ① | 为以下实验作参考 | 298 | 10 | 1.0 |
| ② | 探究温度对反应速率的影响 | |||
| ③ | 298 | 10 | 18.4 |
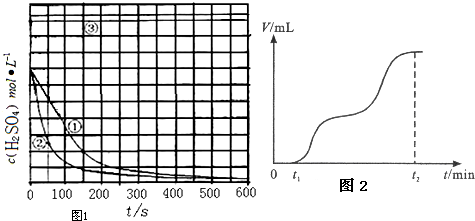
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
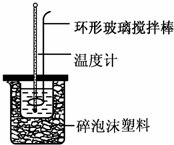 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com