
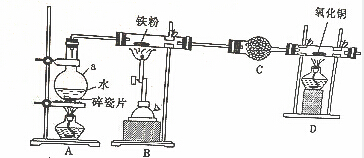
分析 由图可知,A中加热提供水蒸气,在B中发生Fe与水蒸气的反应生成四氧化三铁和氢气,C中干燥管干燥氢气,产生氢气还原氧化铜,B中增重的质量其实就是氧的质量,以此来解答.
解答 解:(1)实验进行铁粉在高温下与水蒸气反应,则A的作用为提供水蒸气,所用玻璃仪器为圆底烧瓶,故答案为:圆底烧瓶;
(2)C中药品为碱石灰,可干燥氢气,故答案为:碱石灰;
(3)D中是氢气还原氧化铜得到铜和水即H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,所以硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成,
故答案为:硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;
(4)在B中Fe与水蒸气反应生成四氧化三铁和氢气,反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(5)B中反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,所以B中增重的质量其实就是氧的质量,B的玻璃管中固体的质量增加16g,即氧元素的质量为16g,物质的量为1mol,氧元素来源于水,水中氢原子与氧原子的物质的量之比为2:1,所以氢原子的物质的量为2mol,则参加反应的水有1mol,根据关系式H2O~H2可知产生的氢气为1mol,在标况下的体积为22.4L,
故答案为:22.4L.
点评 本题考查性质实验的设计,为高频考点,把握发生的反应及装置的作用为解答关键,侧重分析与实验能力的考查,计算时方法有多种,注意技巧,题目难度不大.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
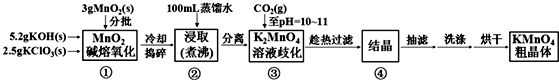
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
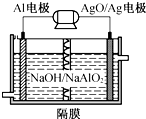 铝电池性能优越,Al-AgO电池可作为水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,则下列说法错误的是( )
铝电池性能优越,Al-AgO电池可作为水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,则下列说法错误的是( )| A. | OH-向Al电极移动 | |
| B. | 正极的电极反应式:O2+2H2O+4e-═4OH- | |
| C. | Al电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O | |
| D. | 当电极上析出0.54 g Ag时,电路中转移的电子为0.005 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com