
根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na 2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30~35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30~35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)反应温度控制在30~35℃,是因为若高于35℃,则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为 。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(3)过滤所得的母液中含有 (以化学式表示),需加入 ,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+==HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。
写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=
【答案】
(1)NH4HCO3分解
反应速率降低
水浴加热
(2)使反应充分进行
NaHCO3的溶解度最小
NaCl NH4Cl NH4HCO3
(3)NaHCO3、NaCl、NH4Cl、NH4HCO3 HCl
(4)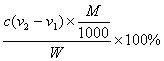
【解析】侯德榜制碱法利用一定条件下NaHCO3溶解度相对较小的特点,在饱和食盐水中先后通入NH3、CO2,获得NaHCO3后灼烧生成Na2CO3。
根据表格,40 ℃以上NH4HCO3溶解度不再给出,因为在35 ℃以上NH4HCO3开始分解。在35 ℃下尽量提高温度可以让反应速度加快,有利于提高单位时间产率。反应液中存在Na+、Cl-、NH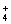 、HCO
、HCO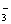 ,参照30 ℃时各物质溶解度可知,此时溶解度最小的NaHCO3最先析出。30 ℃时,NaHCO3溶解度为11.1g,说明Na+、HCO
,参照30 ℃时各物质溶解度可知,此时溶解度最小的NaHCO3最先析出。30 ℃时,NaHCO3溶解度为11.1g,说明Na+、HCO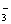 不可能全部沉淀。最终得到的母液中同时存在Na+、Cl-、NH
不可能全部沉淀。最终得到的母液中同时存在Na+、Cl-、NH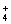 、HCO
、HCO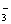 ,向其中加入HCl,可使NaCl溶液循环使用,并能回收NH4Cl。
,向其中加入HCl,可使NaCl溶液循环使用,并能回收NH4Cl。
在滴定过程中,Na2CO3发生两步反应:
Na2CO3 + HCl ==== NaHCO3+NaCl
cV1/1000 cV1/1000
NaHCO3 + HCl====NaCl+H2O+CO2↑
cV1/1000 cV1/1000
Na2CO3消耗的HCl共2cV1/1 000 mol,则NaHCO3消耗的HCl为(cV2/1000-2cV1/1000) mol,样品中NaHCO3的纯度为: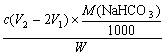 ×100%。
×100%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
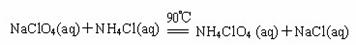
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是 。
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图9)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称) 、干燥。

(3)样品中NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图10所示(加热和仪器固定装置已略去),实验步骤如下:
步骤1:按图10所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤3:准确量取40.00mL约0.1 mol·L-1H2SO4 溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入20mL3 mol·L-1NaOH 溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol·L-1NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1mL。
步骤8.将实验步骤1~7重复2次
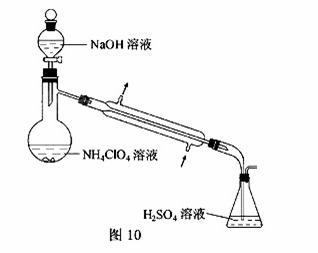
①步骤3中,准确量取40.00mlH2SO4 溶液的玻璃仪器是 。
②步骤1~7中确保生成的氨被稀硫酸完全吸收的实验是 (填写步骤号)。
③为获得样品中NH4ClO4 的含量,还需补充的实验是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关物质燃烧时火焰颜色描述错误的是
A 氢气在氯气中燃烧-苍白色 B 钠在空气中燃烧——黄色
C 乙醇在空气中燃烧——淡蓝色 D 硫在氧气中燃烧——绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
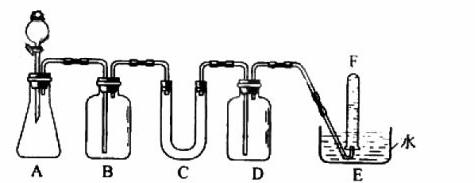
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。
(1)A是制取CO2的装置。写出A中发生反应的化学方程式: 。
(2)填写表中空格:(请在答题卡上填写)
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
(3)写出过氧化钠与二氧化碳反应的化学方程式: 。
(4)试管F中收集满气体后,下一步实验操作是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应不能发生的是
A.CaCO3+2CH3COOH=(CH3COO)2Ca+H2O+CO2↑
B.SiO2+2NaOH=Na2SiO3+H2O
C.AgNO3+HCl=AgCl↓+HNO3
D.2HCl+Cu=CuCl2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取
FeCl3·6H2O晶体。(图中夹持及尾气处理装置均己略去)

(1)装置B中发生反应的化学方程式是___________________________。
(2)装置B中的现象是________________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液 FeCl3溶液
FeCl3溶液 FeCl3·6H2O晶体
FeCl3·6H2O晶体
①步骤Ⅰ中通入Cl2的作用是____________________________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
_____________________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )。
A.一定被氧化
B.一定被还原
C.可能被氧化也可能被还原
D.以上都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为:
2KClO3+4HCl (浓)==2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况(用双线桥法表示)。
(2)浓盐酸在反应中显示出来的性质是________(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)若产生0.1 mol Cl2,则转移的电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
应用化学学科知识,回答下列问题
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H = -566.0 kJ/mol
H2O(g)=H2O(1) ∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ________ 。
(2)水煤气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H= + 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g) △H= + 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
(3)已知A和B在一定条件下可建立如下平衡:2A(g)+B(g) 2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
①达到平衡所需时间是Ⅰ Ⅱ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中C的体积分数关系是Ⅰ Ⅱ。
②平衡时,测得容器Ⅱ中的压强减小了30%,则该容器中A的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com