
短周期元素Q、W、X、Y、Z在元素周期表中的相对位置如下图所示,其中只有Z为金属元素。则下列说法中,正确的是

A.W、X两种元素在自然界中都存在相应的单质
B.Q、Y分别与活泼金属元素形成的化合物中仅含离子键
C.Y、Z分别形成的简单离子中,前者的半径较大
D.X、Z的最高价氧化物对应的水化物之间容易相互发生反应
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源:2014-2015学年天津市高三联考一化学试卷(解析版) 题型:选择题
下列溶液中微粒的物质的量浓度关系正确的是
A.常温下电离常数为Ka的酸HA 溶液中 c (H+)= mol·L-1
mol·L-1
B.0.2mol·L-1 CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
C.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)
D.常温下,向0.1mol/L NH4HSO4溶液中滴加NaOH溶液至中性c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三“二诊”考试化学试卷(解析版) 题型:选择题
相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:
2SO2(g)+O2(g) 2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
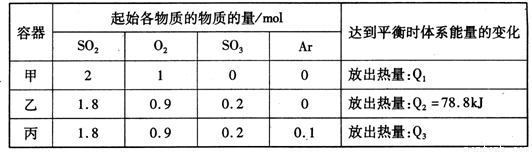
下列叙述正确的是
A.Q1>Q3>Q2 =78.8kJ
B.三个容器中反应的平衡常数均为K=2
C.甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D.若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)= mol/(L·min)
mol/(L·min)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.标况下,1.12LCl2溶于水,转移0.05NA电子
B.向NH4Al(SO4)2稀溶液中逐滴加入过量Ba(OH)2溶液,离子方程式为:NH4++Al3++2SO42-+Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3·H2O
C.常温下,由水电离出的H+浓度为10-13mol·L-1的溶液中,Fe2+、Cl-、:Na+、NO3-可能大量共存
D.葡萄糖(C6H12O6)溶液中:SO42-、MnO42-、K+、H+可以大量共存
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三下学期一模考试理综化学试卷(解析版) 题型:填空题
(17分)二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一。
(1)在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用下图所示气体发生装置中的_____(填下列序号字母)。

(2)SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g) 2SO3(g) △H=a kJ·mol-1
2SO3(g) △H=a kJ·mol-1
在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
(3)某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为___________________________,测得样品pH约为3;为进一步探究由SO3所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,向A中加入适量的NaOH固体,使溶液恰好呈中性(不考虑氧化性物质和其它酸性物质的影响),则此中性溶液中离子的浓度间存在的关系式为:[Na+]=______________;将溶液B久置于空气中,与久置前相比,久置后的溶液B中水的电离程度将__________(填“增大”、“减小”或“不变”)。
(4)工业上常用如下图所示的流程处理工业尾气中的SO2:

上述流程中有一种物质可以再生循环利用,该物质再生的化学方程式为___________________.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三下学期3月一模化学试卷(解析版) 题型:实验题
(17分)用含少量铁的氧化物的氧化铜制取硫酸铜晶体( CuSO4.xH2O)。其流程如下:

已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中可能含有Fe2+,确定该溶液中Fe2+存在的试剂是_______(填序号)
A.H2O2 B.NaOH C.K3[Fe(CN)6] D.KSCN
(2)欲用(1)中选择的检验试剂测定溶液A中Fe2+的浓度,实验前,首先要配制一定物质的量浓度的检验试剂的溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、250mL容量瓶外,还需_______,下列滴定方式中,最合理的是_______(夹持部分略去)

判断达到滴定终点的方法是__________________________________.
写出滴定反应的离子方程式__________________________________.
(3)试剂1为________,试剂2的作用为________,操作1的名称为________。
(4)要得到较纯的产品,试剂3可选用________。
a.NaOH
b.CuO
c.FeO
d.Cu(OH)2
e.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三下学期3月一模化学试卷(解析版) 题型:选择题
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是

A.⑥、⑧、⑨对应单核离子的半径依次增大
B.⑤的三种核素的化学性质不相同
C.④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物
D.⑧、⑨两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三下学期第一次模考理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
I.S4N4的结构如图:

(1)S4N4的晶体类型是__ _。
(2)用干燥的氨作用于S2Cl2的CCl4,溶液中可制S4N4。化学反应方程为:6S2Cl2+16NH3= S4N4 +S8+12NH4Cl
①上述反应过程中,没有破坏或形成的微粒间作用力是__ _。
a.离子键
b.极性键
c.非极性键
d.金属键
e.配位键
f.范德华力
②S2Cl2中,S原子轨道的杂化类型是 __ __。
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:

(3)基态Cu2+的最外层电子排布式为_ _。
(4)二甘氨酸合铜(II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是 _ 。
(5)lmol二甘氨酸合铜(II)含有的二键数目是 _ 。
(6)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是 ______(填写编号)。
查看答案和解析>>
科目:高中化学 来源:2014-2015宁夏银川市高二下学期3月月考化学试卷(解析版) 题型:选择题
下图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是
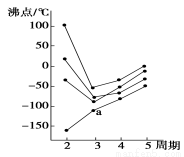
A.H2S B.HCl C.PH3 D.SiH4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com