
【题目】非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛。
⑴ O2-的电子式为___________;
⑵ O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例________(写化学式,任写两种);
⑶ CH3OH在常温下为液态,沸点高于乙烷的主要原因是__________________________;
⑷ Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
危险性 |
|
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
包装 | 钢瓶 |
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用____________________________。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是_________________。
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中
c(Cl-) : c(ClO-)=11 : 1时,则c(ClO-) :c(ClO3-)比值等于_____________。
⑸ 镁是一种较活泼的金属, Mg与Ca类似,也能与C形成某种易水解的离子化合物。已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体。该气体被溴水全部吸收后,溴水增重2.6g。请写出该水解反应方程式___________________________。
【答案】![]() ClO2、O3、Cl2甲醇分子之间能形成氢键而乙烷不能HSO3- + Cl2 + H2O = SO42- + 3H+ + 2Cl-Fe(或者FeCl3)能催化苯与氯气的反应1:2MgC2 + 2H2O = Mg(OH)2 + C2H2↑
ClO2、O3、Cl2甲醇分子之间能形成氢键而乙烷不能HSO3- + Cl2 + H2O = SO42- + 3H+ + 2Cl-Fe(或者FeCl3)能催化苯与氯气的反应1:2MgC2 + 2H2O = Mg(OH)2 + C2H2↑
【解析】
(1)氧原子序数为8,O2-最外层电子数为8,阴离子加括号,标电荷,因此O2-的电子式为![]() ;
;
因此,本题正确答案是:![]() ;
;
(2)O、Cl两元素形成的单质常用来消菌杀毒的有O3、Cl2,化合物有ClO2,
因此,本题正确答案是:ClO2、O3、Cl2;
(3)甲醇(CH3OH)分子之间能形成氢键而乙烷不能,故其沸点高于乙烷,
因此,本题正确答案是:甲醇分子之间能形成氢键而乙烷不能;
(4)①液氯泄漏处理用NaOH或NaHSO3溶液吸收,其中与NaHSO3溶液反应原理为HSO3- + Cl2 + H2O = SO42- + 3H+ + 2Cl-;
②钢瓶中Fe单质可以与Cl2反应生成FeCl3,FeCl3能催化苯的氯代反应;
③Cl2通入KOH溶液发生氧化还原反应,部分氯元素由0价将至-1,部分氯元素由0价升至+1(ClO-)、+5(ClO3-),c(Cl-) : c(ClO-)=11 : 1,设ClO-物质的量为xmol,则Cl-物质的量为11 xmol,该氧化还原反应中,化学价降低得到的电子物质的量为11 xmol,化学价升高至+1失去的电子物质的量为xmol,则化学价升高至+5失去的电子物质的量为11 xmol - xmol =10 xmol ,则n(ClO3-)=![]() =2xmol,则c(ClO-) :c(ClO3-)=x:2x=1:2。
=2xmol,则c(ClO-) :c(ClO3-)=x:2x=1:2。
因此,本题正确答案是:HSO3- + Cl2 + H2O = SO42- + 3H+ + 2Cl-;Fe(或者FeCl3)能催化苯与氯气的反应;1:2;
(5)根据气体的物质的量和溴水增重质量可知该气体的相对分子质量为26,Ca与C形成常见易水解的离子化合物为电石CaC2,CaC2水解的方程式为:CaC2+ 2H2O = Ca (OH)2 + C2H2↑,乙炔的相对分子质量为26,符合题目要求,钙镁化学性质相似,故镁碳化合物水解后的化学方程式为MgC2 + 2H2O = Mg(OH)2 + C2H2↑。
因此,本题正确答案是:MgC2 + 2H2O = Mg(OH)2 + C2H2↑。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】(题文)向一定量Fe和Fe2O3的混合物中加入120mL一定浓度的稀硝酸恰好使混合物溶解,同时可得到标准状况下1.344L NO气体.向所得到的溶液中再加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,得到11.76g铁单质.则原稀硝酸的物质的量浓度为( )
A. 2molL-1 B. 4molL-1
C. 5.75molL-1 D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)
4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是
2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是

A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率
C. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
D. 氮气氧化为NO的热化学方程式为:N2(g)+O2(g)![]() 2NO(g)△H=-181.5kJ/mol
2NO(g)△H=-181.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
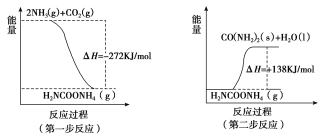
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为___________________________。
(2)已知反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
温度(℃) | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
①该反应的化学平衡常数K的表达式为____________,a________0(填“>”、“<”或“=”)。在500 ℃ 2 L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为________,生成CO的平均速率v(CO)为_______________。
②700 ℃反应达到平衡后,要使反应速率增大且平衡向右移动, 可采取的措施有 ___________。
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式_____________________,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=_________(溶液电解前后体积的变化忽略不计)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。

下列各表述与示意图一致的是
A. 图①三种离子的物质的量之比为:n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B. 图①中使用的NaOH的浓度为2mol/L
C. 图②中物质A反应生成物质C,△H>0
D. 图②中曲线表示某反应过程的能量变化。 若使用催化剂,B点会降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把11.2 g铁加入到500 mL盐酸中,在标准状况下放出氢气的体积是3.36 L,盐酸的物质的量浓度是( )
A.0.2 mol·L-1B.0.3 mol·L-1C.0.4 mol·L-1D.0.6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知X、Y为短周期元素,两元素形成化合物XY2,已知其原子序数分别为a和b,则a不可能为( )
A. b+4 B. b-5 C. b+6 D. b+8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com