
����Ŀ����5 mL 0.005 mol��L��1��FeCl3��Һ��5 mL0.01 mol��L��1��KSCN��Һ��ϣ�����ƽ�⣺FeCl3��3KSCN![]() 3KCl��Fe(SCN)3(��ɫ)��
3KCl��Fe(SCN)3(��ɫ)��
(1)���μӱ���FeCl3��Һ4�Σ�ƽ����________�����ƶ�����Һ��ɫ________��
(2)���μ�1 mol��L��1KSCN��Һ4�Σ�ƽ����________�����ƶ�����Һ��ɫ________��
(3)���μ�0.01 mol��L��1NaOH��Һ4�Σ������____ (����ɫ)������c(Fe3��)___��ƽ����______�����ƶ�����Һ��ɫ________��
(4)����������KCl���壬��ƽ��________�ƶ���ԭ��________________________��
���𰸡�����Ӧ ���� ����Ӧ ���� ���ɫ ��С �淴Ӧ ��dz �� KCl�����뷴Ӧ
��������
�Ȼ��������軯�������Ȼ��غ����軯���ķ�Ӧ��ʵ����Fe3++3SCN-![]() Fe(SCN)3��
Fe(SCN)3��
��1������ƽ���ʱ��������Ũ����0.005mol/L�����μӱ����Ȼ�����Һ��������Ũ������ƽ��������Ӧ�����ƶ������軯��Ũ��������Һ��ɫ����ʴ�Ϊ������Ӧ�����
��2������ƽ���ʱ�����軯��Ũ����0.01mol/L�����μ�1mol/L�����軯����Һ�����ʹ���������Ũ������ƽ��������Ӧ�����ƶ������軯��Ũ������ɫ����ʴ�Ϊ������Ӧ�����
��3�����μ�����������Һ�������Ӻ����������ӻ����ɺ��ɫ����������������ʹ������Ũ�Ƚ��ͣ�ƽ�������ƶ������軯��Ũ��Ҳ���ͣ���Һ��ɫ��dz���ʴ�Ϊ�����ɫ����С���淴Ӧ����dz��
��4�������Ȼ��ز����뷴Ӧ�����Լ��Ȼ��ع��壬ƽ�ⲻ�ƶ����ʴ�Ϊ������KCl�����뷴Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڷ���ȱ����ƶѪ������Ч�ɷ�һ��Ϊ�������������������������������������������ȡ��ش��������⣺
��1���ܱ�ʾ������͵��������ӵĵ����Ų�ʽ��_________�����ţ���
a.[Ar]3d54s2 b.[Ar]3d54s1 c.[Ar]3d64s2 d.[Ar]3d6
��2�������ἴ������(HOOCCH2CH2COOH)��������������е縺������ԭ����_____��̼ԭ�ӵ��ӻ���ʽ��______�������������д�����λ�����ڸ���λ������λԭ����____������ԭ����____��
��3��������������ụΪ˳���칹�壬����볣�����±���
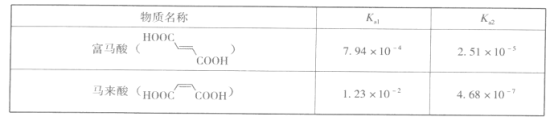
�������ĽǶȽ��������������볣������С�����������������볣�����ϴ��ԭ��____��
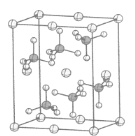
��4����-���������ľ����ṹ��ͼ��ʾ���侧������Ϊa= 870 pm��b=680 pm��c=479 pm����=��=��=90�㣬Fe2+ռ�ݾ������㡢���ġ����ĺ����ġ��ڸþ����У�����������ڿռ�����____�ֿռ�ȡ����������������ӵĸ�����____����ԭ����Χ�������ԭ�ӵĸ���Ϊ____���谢���ӵ�������ֵΪNA����þ�����ܶ���____ g��cm-3���г��������ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼΪ���ֻ������Ԫ�����ʾ��ͼ������˵���������

A. ����Ϊij�־��д����õĻ��������ˮ�����Ϊ������
B. ����Ϊ֬�����������������Ƥ�º�����������Χ
C. ����Ϊ������Ŵ����ʣ�����͵��������Ⱦɫ��
D. ����Ϊ��ԭ��������Ҫ�ֲ����˺Ͷ���ļ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���������Դ�����Ϊ����ʵ���������÷���м��ȡ���������[(NH4)2Fe(SO4)2��6H2O]��ij��ȤС���Է���м�Ƶ���������狀����������Ʊ���ˮ�ϲ�������(FeC2O4��2H2O)����һ���Ʊ��ߴ��Ȼ�ԭ���ۡ�

��֪��FeC2O4��2H2O������ˮ��150�濪ʼʧ�ᾧˮ��H2C2O4������ˮ���ܽ�����¶����߶�������ش��������⣺
(1)������У�H2C2O4�Թ�������Ҫԭ����________��
(2)Ϊ����߲���۵õ���FeC2O4��2H2O�Ĵ��ȣ�����________(������ˮ������ˮ��������ˮ�Ҵ���)ϴ�ӣ�����ϴ���Ƿ�ɾ��IJ�����________��
(3)ʵ�ֲ���ܱ����õ�������������________(��ѡ������a. �ձ���b. ������c. ������ƿ��d. ����¯��e. ������f. ��ƿ)��
(4)Ϊʵ�ֲ���ݣ�������̼�ۻ�ԭFe2O3��������________��
(5)�������������Ҫ�Ĺ�ҵԭ�ϣ����ܽ��������ʾ��
10 | 20 | 30 | 40 | 50 | 60 | |
(NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO4��7H2O | 40.0 | 48.0 | 60.0 | 73.3 | �� | �� |
(NH4)2Fe(SO4)2��6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(ע�⣺����73.3�棬FeSO4��7H2O�����ֽ�)
����м(������)�����ᡢ�����Ϊԭ�ϣ�������ȡ��������茶����ʵ�鷽��������м������ƿ�У�______����ȴ�����ˣ�������ˮϴ����м�����ԣ�����м������ƿ�У�_____����м��ȫ�ܽ⣬_____����ȴ�ᾧ������ˮ�Ҵ�ϴ��2��3�Σ����¸��[ʵ���б���ʹ�õ��Լ�����м��1.0 mol��L��1��Na2CO3��Һ��3.0 mol��L��1��H2SO4��Һ������(NH4)2SO4��Һ]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 mol����������4 mol̼�����ƹ����ϣ����ܱ���������120��C��ַ�Ӧ���ų����壬��ȴ���й�����������з�����ȷ����
A. ����������4 mol Na2CO3
B. ����������Na2CO3��NaOH�Ļ����
C. ��Ӧ��ת��4 mol����
D. �ų���������3 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298Kʱ����20mLŨ�Ⱦ�Ϊ0.1 mol��L��1��MOH��NH3��H2O���Һ�еμ�0.1mol��L��1��CH3COOH��Һ����û��Һ�ĵ����ʣ���ʾ�������Ե��������������CH3COOH��Һ�����(V)�Ĺ�ϵ��ͼ��ʾ����֪CH3COOH��Ka��1.8��10��5��NH3��H2O��Kb =1.8��10��5������˵����ȷ����
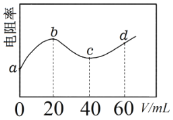
A.b��c���̷����ķ�Ӧ��MOH+CH3COOH=CH3COOM+H2O
B.c����Һ�У�c(CH3COOH)+c(CH3COO�C)=2c(NH4+)
C.d ����Һ�У�c(CH3COO�C)c(CH3COOH)>c(M+)>c(H+)>c(OH�C)
D.a��c������ˮ�ĵ���̶�һֱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ҹ��Ƽ��ɹ����漰���ʵ�Ӧ���У�������������ѧ�仯����
|
|
|
|
A���״���������������������Դ���� | B��뮡������������̫�����˾۱�ȼ�� | C��ƫ�����������������칬�������Ļ��ȼ�� | D�����ɿ�ȼ����������Ϊ��Դʹ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H5IO6(���ߵ���)�����ڹ�ȷ��ⶨ���µ��Լ�����ҵ����NaIO3�Ʊ�H5IO6��������ͼ��
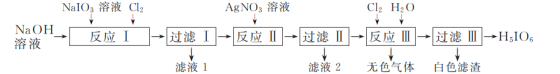
��1������Ӧ����������ͼ��ʾ��װ���н��С��÷�Ӧ���ɲ�����ˮ��Na2H3IO6�����ӷ���ʽΪ____����Ҫ���Cl2�������ʣ��ɶ�װ�ý��иĽ��Ĵ�ʩΪ___��
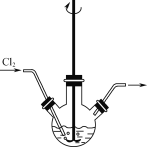
��2����Ӧ�����ɲ�����ˮ�ĺ�ɫAg5IO6������Һ2����__(����������������������)�ԡ�
��3������ɫ������Ϊ__(�ѧʽ)��
��4����ҵ��Ϊ���ͳɱ������ٶԻ�������Ⱦ������������Ҫ���Ƽ���Cl2��AgNO3�����ʵ���֮��Ϊn(Cl2)��n(AgNO3)=__��
��5��H5IO6����ǿ�����ԣ��ɽ�FeSO4����ΪH2FeO4����������ԭΪHIO3���÷�Ӧ�Ļ�ѧ����ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ƺ�ͭ�Ͻ����������ƸƵ������缫���ϣ��ش��������⣺
(1)��̬ͭԭ�ӵļ۵����Ų�ʽΪ_________________��
(2)CaCO3���·ֽ���Ƶ�CaO��CaO�� C ��һ�������¿�����CaC2��CaC2��ˮ��Ӧ���� Ca(OH)2��һ�� 4 ԭ��������ӡ�
��CaCO3�������ӵĿռ乹��Ϊ______________��
�ڸ���������� �� ������������Ŀ֮��Ϊ_____________��
��д�� 2 ���� ![]() ��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ______________��
��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ______________��
(3)��ҵ�ϵ�� CaCl2��Ca�������õ�� CaO ��ԭ����_______________��
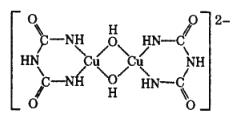
(4)�ڼ�����Һ�У������� HN( CONH2)2�� CuSO4��Ӧ�õ�һ��������ɫ���ʣ���ṹ��ͼ��ʾ���÷�Ӧԭ�������ڼ��鵰���ʻ����������Ļ���������������̼ԭ���뵪ԭ�ӵ��ӻ����ͷֱ�Ϊ__________��________��
(5)һ�ָ�ͭ�Ͻ�Ľṹ�ɿ���ͼa��b ����ԭ�Ӳ㽻��ѻ����ж���c���侧����ͼd��
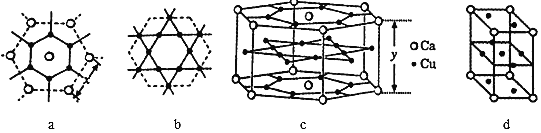
��aͼCa-Ca �����Ϊx pm��cͼ��Ca-Ca�����Ϊy pm����֪ԭ��ӵ�еľ����ܶ������ԭ�ӵĸ����и�ԭ�ӵ���λ������c��Caԭ�ӵ���λ��(Cuԭ��)Ϊ_______��
���谢���ӵ�������ֵΪ NA����ø�ͭ�Ͻ���ܶ���_______gcm-3(�г��������ʽ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com