
【题目】298K时,向20mL浓度均为0.1 mol·L-1的MOH和NH3·H2O混合液中滴加0.1mol·L-1的CH3COOH溶液,测得混合液的电阻率(表示电阻特性的物理量)与加入CH3COOH溶液的体积(V)的关系如图所示。已知CH3COOH的Ka=1.8×10-5,NH3·H2O的Kb =1.8×10-5。下列说法正确的是
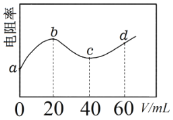
A.b→c过程发生的反应:MOH+CH3COOH=CH3COOM+H2O
B.c点溶液中:c(CH3COOH)+c(CH3COO–)=2c(NH4+)
C.d 点溶液中:c(CH3COO–)c(CH3COOH)>c(M+)>c(H+)>c(OH–)
D.a→c过程中水的电离程度一直在增大
【答案】D
【解析】
溶液中离子浓度越小,溶液的导电率越小,电阻率越大,向混合溶液中加入等物质的量浓度的CH3COOH溶液时,发生反应先后顺序是:MOH+CH3COOH=CH3COOM+H2O,NH3·H2O+CH3COOH=CH3COONH4+H2O,a-b溶液中电阻率增大,b点最大,因为溶液体积增大导致b点离子浓度减小,b点溶液中溶质为CH3COOM和NH3·H2O。继续加入醋酸溶液,NH3·H2O是弱电解质,生成CH3COONH4是强电解质,导致溶液中离子浓度增大,电阻率减小,c点时醋酸和NH3·H2O恰好完全反应生成醋酸,c点溶液中溶质为CH3COOM和CH3COONH4,且二者的物质的量相等,溶液中离子浓度增大,电阻率减小;随着CH3COOH溶液继续加入,溶液体积增大,离子浓度减小,溶液电阻率逐渐增大。据此分析。
A.由图可知,向混合溶液中加入等物质量浓度的CH3COOH溶液时,电阻率先增大后减小,说明发生了两步反应,发生反应先后顺序为:MOH+CH3COOH=CH3COOM+H2O,NH3·H2O+CH3COOH=CH3COONH4+H2O,所以MOH是强碱,先和酸反应,A项错误;
B.c点时,加入醋酸40mL,此时溶液中的溶质为CH3COOM和CH3COONH4,且二者的物质的量浓度相等,根据物料守恒,则有c(CH3COOH)+c(CH3COO–)=2[c(NH4+)+c(NH3·H2O)],B项错误;
C.d点时加入醋酸60mL,溶液中溶质为CH3COOM、CH3COONH4和CH3COOH,且三者的物质的量浓度相等,CH3COONH4是中性盐,溶液相当于CH3COOM和CH3COOH等物质的量混合,根据![]() ,可知CH3COOH的电离程度大于CH3COO–的水解程度,所以溶液显酸性,溶液中离子浓度大小顺序为:c(CH3COO–)>c(M+)>c(CH3COOH)>c(H+)>c(OH–),C项错误;
,可知CH3COOH的电离程度大于CH3COO–的水解程度,所以溶液显酸性,溶液中离子浓度大小顺序为:c(CH3COO–)>c(M+)>c(CH3COOH)>c(H+)>c(OH–),C项错误;
D.a→c过程中,溶液碱性逐渐减弱,水电离程度增大,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空
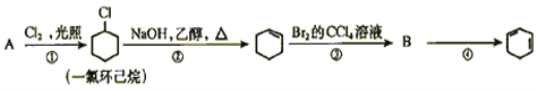
(1)A的名称是__________B的结构简式是_________
(2)②的反应类型是__________。③的反应类型是__________。
(3)反应④的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,反应物中每个原子都参加氧化还原反应的是( )
A.2KNO3+3C+S![]() K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
B.2NaCl![]() 2Na+Cl2↑
2Na+Cl2↑
C.2AgNO3![]() 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于________层,配位数是________;B属于________层,配位数是________。
(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是________,平均每个晶胞所占有的原子数目是________。

(3)有资料表明,只有钋的晶体中的原子具有如图2所示的堆积方式,钋位于元素周期表的第________周期第__________族,元素符号是________,最外电子层的电子排布式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5 mL 0.005 mol·L-1的FeCl3溶液与5 mL0.01 mol·L-1的KSCN溶液混合,建立平衡:FeCl3+3KSCN![]() 3KCl+Fe(SCN)3(红色)。
3KCl+Fe(SCN)3(红色)。
(1)若滴加饱和FeCl3溶液4滴,平衡向________方向移动,溶液红色________。
(2)若滴加1 mol·L-1KSCN溶液4滴,平衡向________方向移动,溶液红色________。
(3)若滴加0.01 mol·L-1NaOH溶液4滴,则产生____ (填颜色)沉淀,c(Fe3+)___,平衡向______方向移动,溶液红色________。
(4)若加入少量KCl固体,则平衡________移动,原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH溶液捕获CO2。向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL。在稀释后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.
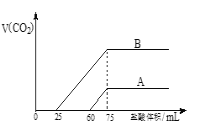
(1)曲线B表明原溶液中通入CO2后,所得溶液中的溶质为(写化学式)_____________,其物质的量之比为__________________。当耗盐酸0<v(HCl)<25 mL时发生的离子反应为:____________。
(2)曲线A表明,最初通入的CO2在标准状况下的体积为_________mL。
(3)通过计算求出原NaOH溶液的物质的量浓度______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在古代,我国人民就积累了不少对化学物质变化的认识。例如,晋代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这句话中的丹砂指的是HgS,下列有关说法正确的是( )
A.这个过程只涉及物理变化
B.“积变又还成丹砂”过程中发生反应:HgS![]() Hg+S
Hg+S
C.实验室中不慎洒落的水银不能用硫黄处理
D.“丹砂烧之成水银”过程中还可能产生SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室测定铬铁矿中铬(Cr)含量的步骤如下:
步骤1:准确称取0.2000g铬铁矿试样放入锥形瓶中,加入适量磷酸和硫酸的混合酸,加热使试样完全溶解,冷却。
步骤2:向上述溶液中滴加5滴1%MnSO4溶液,再加入一定量的(NH4)2S2O8溶液,摇匀至溶液呈紫红色[先后发生Cr3+![]() Cr2O72-、Mn2+
Cr2O72-、Mn2+![]() MnO4-]。
MnO4-]。
步骤3:上述溶液加热煮沸至紫红色褪去[除去过量的(NH4)2S2O8和生成的MnO4-],冷却。
步骤4:用0.2000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定上述溶液至终点(发生Cr2O72-![]() Cr3+),消耗19.50mL标准溶液。
Cr3+),消耗19.50mL标准溶液。
(1)(NH4)2S2O8中阴离子的结构如图所示。从结构分析,(NH4)2S2O8置于棕色试剂瓶并于阴凉处保存的原因是__。
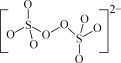
(2)“步骤2”中加入5滴1%MnSO4溶液的目的是__。
(3)“步骤3”中,如果继续加热煮沸时间不充足,会使铬含量的测定结果___(填“偏大”“不变”或“偏小”)。
(4)计算铬铁矿中铬的质量分数___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,书写正确的是( )
A.盐酸与石灰石反应:CO32ˉ+2H+ = CO2↑+H2O
B.铁与稀盐酸反应:2Fe+6H+ = 2Fe3++3H2↑
C.氢氧化铁胶体的制备:FeCl3 + 3H2O = Fe(OH)3+3HCl
D.硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42ˉ = BaSO4↓+Cu(OH)2↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com