
【题目】已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( ) 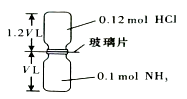
A.反应后瓶内压强是反应前的 ![]()
B.装置中氢元素的总质量为0.42 g
C.生成物的分子数目为0.1 NA
D.反应结束后,两个集气瓶很容易分开
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,向1L 0.1molL﹣1 CH3COOH溶液中加入0.1mol CH3COONa固体,则醋酸的电离平衡向 (填“正”或“逆”)反应方向移动;溶液中![]() 的值 (填“增大”、“减小”或“不变”).
的值 (填“增大”、“减小”或“不变”).
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3H2O.已知:
a.常温下,醋酸和NH3H2O的电离平衡常数均为1.74×10﹣5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O.
则CH3COONH4溶液呈 性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈 性,NH4HCO3溶液中物质的量浓度最大的离子是 (填化学式).
(3)99℃时,Kw=1.0×10﹣12 , 该温度下测得0.1molL﹣1 Na2A溶液的pH=6.
①H2A在水溶液中的电离方程式为 .
②该温度下,将0.01molL﹣1 H2A溶液稀释到20倍后,溶液的pH= .
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气 .
A.盐酸多 B.H2A多
C.一样多 D.无法确定
④将0.1molL﹣1 H2A溶液与0.2molL﹣1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把4.48LCO2通过一定量的固体过氧化钠后收集到3.36L气体(气体的测量均在标准状况下),所得气体的总质量是
A. 3.2g B. 4.8g C. 5.4g D. 6g
【答案】D
【解析】令参加反应的CO2气体的体积为a,生成的O2的体积为b,则:
2CO2+2Na2O2=2Na2CO3+O2↑,气体体积减小△V
2 1 1
a b 4.48L-3.36L=1.12L
解得:a=2.24L,b=1.12L,
生成氧气的体积1.12L,小于3.36L,故二氧化碳有剩余,
所以:3.36L气体中CO2体积为4.48L-2.24L=2.24L,O2的体积为1.12L,
所以4.48L气体的质量为![]() ×44g/mol+
×44g/mol+![]() ×32g/mol=6.0g。答案选D。
×32g/mol=6.0g。答案选D。
点睛:本题考查根据方程式的计算,难度中等,本题采取差量法计算,可以避免单独讨论或计算判断最后气体的组成,注意差量法的理解与运用。根据气体的体积差,通过差量法计算参加反应的二氧化碳体积、生成的氧气的体积,判断3.36L气体的组成及各成分的体积,再根据n=![]() 计算各组分气体的物质的量,利用m=nM计算质量。
计算各组分气体的物质的量,利用m=nM计算质量。
【题型】单选题
【结束】
26
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。请回答下列问题。
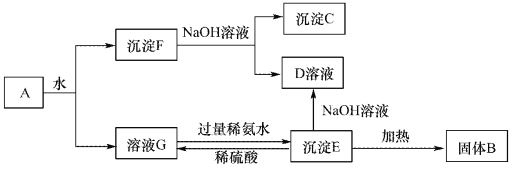
(1)沉淀F与NaOH溶液反应的离了方程式为_______________。
(2)沉淀C与稀硫酸反应的离子方程式为_______________。
(3)溶液G与过量稀氨水反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质(括号内的物质为杂质)的方法中错误的是
A.FeSO4 (CuSO4):加足量铁粉后,过滤
B.CO (CO2):用NaOH溶液洗气后干燥
C.MnO2 (KCl):加水溶解后,过滤、洗涤、烘干
D.CO2 (HCl):用NaOH溶液洗气后干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛. 
(1)为了减缓海水对钢闸门A和C的腐蚀,图1中,材料B可以选择(填字母序号). a.锌板 b.铜板 c.碳棒
图2中,钢闸门C作极.若用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极
反应式为 , 检测该电极反应产物的试剂是 .
(2)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图3所示(质子交换膜只允许H+自由通过).该电池的正极反应式为 .
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸(弱酸)的原理如图4所示(图中“HA”表示乳酸 分子,A﹣表示乳酸根离子).
①阳极的电极反应式为 .
②简述浓缩室中得到浓乳酸的原理: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原子的核外电子排布,下列说法正确的是( )
A.M层为最外层时,最多可容纳18个电子
B.在K层上运动的电子能量最高
C.次外层上最多可容纳32个电子
D.N层上最多可容纳32个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:
①H2②铝③CaO④CO2⑤H2SO4 ⑥Ba(OH)2⑦红褐色的氢氧化铁液体⑧氨水⑨稀硝酸⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
属于该类的物质 |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为 .
(3)⑩在水中的电离方程式为 ,
(4)少量的④通入⑥的溶液中反应的离子方程式为 .
(5)②与⑨发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是(填化学式),氧化剂与还原剂的物质的量之比是 , 当有5.4gAl发生反应时,转移电子的物质的量为 . 该反应的离子方程式为 .
(6)白色沉淀变成灰绿色再变成红褐色沉淀的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中大量存在以下五种离子:Cl﹣、SO42﹣、Fe3+、H+、M,其物质的量浓度之比为c(Cl﹣):c(SO42﹣):c(Fe3+):c(H+):c(M)=5:3:2:3:2,则M可能是( )
A.Ag+
B.Mg2+
C.NO ![]()
D.Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1: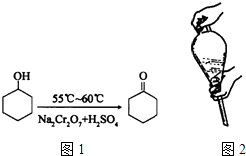
环己醇和环己酮的部分物理性质见下表:
物质 | 相对分子质量 | 沸点(℃) | 密度(gcm﹣3、20℃) | 溶解性 |
环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯.其主要步骤有(未排序):
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分离提纯步骤的正确顺序是 .
(2)b中水层用乙醚萃取的目的是 .
(3)以下关于萃取分液操作的叙述中,不正确的是 .
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图2用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞,待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是 . 蒸馏除乙醚的操作中,采用的加热方式为 .
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是 .
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是(保留两位有效数字).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com