
【题目】现有下列十种物质:
①H2②铝③CaO④CO2⑤H2SO4 ⑥Ba(OH)2⑦红褐色的氢氧化铁液体⑧氨水⑨稀硝酸⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
属于该类的物质 |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为 .
(3)⑩在水中的电离方程式为 ,
(4)少量的④通入⑥的溶液中反应的离子方程式为 .
(5)②与⑨发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是(填化学式),氧化剂与还原剂的物质的量之比是 , 当有5.4gAl发生反应时,转移电子的物质的量为 . 该反应的离子方程式为 .
(6)白色沉淀变成灰绿色再变成红褐色沉淀的化学方程式: .
【答案】
(1)②;③④;⑧⑨;⑦;③⑤⑥⑩
(2)Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
(3)Al2(SO4)3=2Al3++2SO ![]()
(4)CO2+Ba2++2OH﹣=BaCO3↓+H2O
(5)HNO3;1:1;0.6mol;Al+4H++NO ![]() =Al3++NO↑+2H2O
=Al3++NO↑+2H2O
(6)4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】解:(1)铝是只有金属铝元素组成的金属单质,③Na2O和④CO2中含有两种元素其中一种元素是氧元素,属于氧化物,⑧氨水和⑨稀硝酸属于混合物,⑦红褐色的氢氧化铁液体属于胶体分散系,③⑤⑥⑩在水溶液或者熔融状态下能导电,属于电解质,所以答案是:
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
属于该类的物质 | ② | ③④ | ⑧⑨ | ⑦ | ③⑤⑥⑩ |
2)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣=H2O,说明是强酸强碱反应生成溶于水的盐的离子反应,氢氧化钡和稀硝酸反应符合,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;所以答案是:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;(3)Al2(SO4)3属于盐是强电解质,水溶液中完全电离,电离方程式为:Al2(SO4)3=2Al3++2SO42﹣;所以答案是:Al2(SO4)3=2Al3++2SO42﹣;(4)少量的④通入⑥的溶液中反应,是二氧化碳通入氢氧化钡溶液中反应生成碳酸钡沉淀和水,反应的离子方程式为:CO2+Ba2++2OH﹣=BaCO3↓+H2O;所以答案是;CO2+Ba2++2OH﹣=BaCO3↓+H2O;(5)②与⑨发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,反应中氮元素化合价从+5价变化为+2价,化合价降低硝酸做氧化剂,该反应的氧化剂是HNO3;依据电子守恒可知1molAl全部反应,氧化剂和还原剂转移电子总数为3mol,氧化剂和还原剂物质的量之比为1:1;当有5.4g Al物质的量= ![]() =0.2mol,发生反应电子转移0.6mol,反应的离子方程式为:Al+4H++NO3﹣=Al3++NO↑+2H2O;所以答案是:HNO3;1:1;0.6mol;Al+4H++NO
=0.2mol,发生反应电子转移0.6mol,反应的离子方程式为:Al+4H++NO3﹣=Al3++NO↑+2H2O;所以答案是:HNO3;1:1;0.6mol;Al+4H++NO ![]() =Al3++NO↑+2H2O;(6)氢氧化亚铁不稳定,在空气中很容易被氧化成氢氧化铁,所以白色沉淀迅速变成灰绿色最后变成红褐色,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;所以答案是:4Fe(OH)2+O2+2H2O=4Fe(OH)3 .
=Al3++NO↑+2H2O;(6)氢氧化亚铁不稳定,在空气中很容易被氧化成氢氧化铁,所以白色沉淀迅速变成灰绿色最后变成红褐色,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;所以答案是:4Fe(OH)2+O2+2H2O=4Fe(OH)3 .


科目:高中化学 来源: 题型:
【题目】紫菜与海带类似,是一种富含生物碘的海洋植物;商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取。已知:
乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
密度/g·cm-3 | 0.789 3 | 1.595 | 0.71~0.76 | 4.94 |
沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
以下为某兴趣小组模拟从紫菜提取碘单质的过程。
![]()
粗产品
(1)实验室中焙烧紫菜用到的仪器有()(填写相应的字母)。
A.烧杯
B.表面皿
C.蒸发皿
D.坩埚
E.试管
F.酒精灯
G.泥三角
(2)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式
(3)操作①的名称是;试剂A为(填本题表格中一种最佳化学试剂的名称),不使用另外两种试剂的主要原因分别是:
①;
②。
(4)操作②中所用的主要玻璃仪器为 , 振荡、静置,应首先将分离出来。
(5)将下列装置图中缺少的必要仪器补画出来以最终将单质碘与试剂A分离。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X和Y能发生如下反应:X+Y H2O+盐,下列有关X和Y所属种类的说法中一定不正确的是 ( )
A | B | C | D | |
X | 酸性氧化物 | 碱性氧化物 | 盐 | 酸性氧化物 |
Y | 碱 | 酸 | 碱 | 碱性氧化物 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( ) 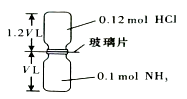
A.反应后瓶内压强是反应前的 ![]()
B.装置中氢元素的总质量为0.42 g
C.生成物的分子数目为0.1 NA
D.反应结束后,两个集气瓶很容易分开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题.
族 | IA | 0 | |||||||
1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
2 | ② | ③ | ⑥ | Ne | |||||
3 | ④ | ⑤ | Al | S | |||||
(1)⑥表示的元素是;
(2)②的原子结构示意图是;
(3)由①和③两种元素组成的化合物的化学式是;
(4)④和⑤两种元素的金属性强弱顺序是④⑤(填“<”或“>”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3 , 溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w= ![]() ×100%
×100%
②c= ![]()
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w.
A.①③
B.②③
C.①②
D.只有②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,实验测得1.0mol/LNH4HCO3溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是( )
A.常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B.pH=13时,溶液中不存在HCO3-的水解平衡
C.pH由8~11时,c(CO32-)·c(H+)/c(HCO3-)不变
D.pH=3时,有c(NH4+)+c(NH3·H2O) =c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com