
【题目】常温下,实验测得1.0mol/LNH4HCO3溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是( )
A.常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B.pH=13时,溶液中不存在HCO3-的水解平衡
C.pH由8~11时,c(CO32-)·c(H+)/c(HCO3-)不变
D.pH=3时,有c(NH4+)+c(NH3·H2O) =c(HCO3-)+c(CO32-)+c(H2CO3)
【答案】C
【解析】A、根据越弱越水解原理,1.0mol/LNH4HCO3溶液pH=8.0,说明铵根水解程度小于碳酸氢根离子,应有Kb(NH3H2O)>ka(H2CO3)>Ka2(H2CO3),故A不符合题意;
B、只要存在碳酸氢根离子就存在HCO3-的水解平衡,故B不符合题意;
C、温度不变,碳酸氢根离子的电离平衡常数不变,故C符合题意;
D、pH=3时,NH4HCO3会与氢离子反应生成二氧化碳,所以c(NH4+)+c(NH3H2O)>c(HCO3-)+c(CO32-)+c(H2CO3),故D不符合题意;
故选C。根据溶液中离子浓度与pH的关系图进行判断电离平衡常数的大小、溶液中离子浓度大小等即可。


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】现有下列十种物质:
①H2②铝③CaO④CO2⑤H2SO4 ⑥Ba(OH)2⑦红褐色的氢氧化铁液体⑧氨水⑨稀硝酸⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
属于该类的物质 |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为 .
(3)⑩在水中的电离方程式为 ,
(4)少量的④通入⑥的溶液中反应的离子方程式为 .
(5)②与⑨发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是(填化学式),氧化剂与还原剂的物质的量之比是 , 当有5.4gAl发生反应时,转移电子的物质的量为 . 该反应的离子方程式为 .
(6)白色沉淀变成灰绿色再变成红褐色沉淀的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1: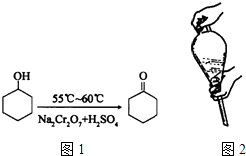
环己醇和环己酮的部分物理性质见下表:
物质 | 相对分子质量 | 沸点(℃) | 密度(gcm﹣3、20℃) | 溶解性 |
环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯.其主要步骤有(未排序):
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分离提纯步骤的正确顺序是 .
(2)b中水层用乙醚萃取的目的是 .
(3)以下关于萃取分液操作的叙述中,不正确的是 .
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图2用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞,待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是 . 蒸馏除乙醚的操作中,采用的加热方式为 .
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是 .
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是(保留两位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质俗名与化学式对应错误的是
A.胆矾 CuSO45H2O
B.重晶石 BaSO3
C.绿矾 FeSO47H2O
D.明矾KAl(SO4)212H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对某未知溶液中离子的检验方法及其结论一定正确的是( )
A.取溶液进行焰色反应显黄色,一定含有Na+
B.滴加BaCl2溶液,产生白色沉淀,证明有SO ![]()
C.滴加KSCN溶液,变为血红色,溶液中含Fe2+
D.加入稀盐酸产生无色气体,一定含有CO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物,氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物.工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-).
反应方程式为:[Cu(NH3)2]Ac+CO+NH3 ![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式 .
②氨水溶液中各元素原子的电负性从大到小排列顺序为 .
③醋酸分子中的两个碳原子,甲基(-CH3)碳和羧基(-COOH)碳的杂化方式分别是 .
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 .
a.离子键 b.配位键 c.σ键 d.π键
(2)某离子型氢化物化学式为XY2 , 晶胞结构如图 所示,其中6个Y原子(○)用阿拉伯数字1~6标注.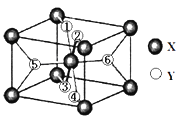
①已知1、2、3、4号Y原子在晶胞上、下面上.则5、6号Y原子均在晶胞 . (填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是 . a.XY2晶体>硅烷晶体>固态氨 b.XY2晶体>固态氨>硅烷晶体
c.固态氨>硅烷晶体>XY2晶体 d.硅烷晶体>固态氨>XY2晶体
(3)一种铜合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为;若该晶体的晶胞参数为a pm,则该合金密度为g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,会产生H2;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.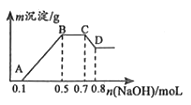
则:
(1)溶液中一定含有的阳离子有 , 一定不含有的离子有 .
(2)C→D的离子方程式为 .
(3)由A→B及C→D段有关数据可计算出的某两种离子的物质的量浓度分别为molL﹣1和molL﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com