
【题目】下列物质的变化过程中,只需克服分子间作用力的是( )
A.食盐溶解B.氯化氢溶于水C.干冰升华D.氯化铵分解
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
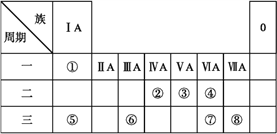
Ⅰ.(1)请画出元素⑧的阴离子结构示意图: ________________。
(2)④⑤⑦的原子半径由小到大的顺序为________________ (填元素符号)。
(3)⑤和⑥的最高价氧化物对应水化物的碱性强弱为________>________ (填化学式)。
(4)④⑤两种元素的原子按1∶1组成的常见化合物的化学式为________________。
Ⅱ.由表中①~⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),请回答下列问题:
![]()
(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,检验此C溶液中金属离子的方法是;______,又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式:______。
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,实验测得1.0mol/LNH4HCO3溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是( )
A.常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B.pH=13时,溶液中不存在HCO3-的水解平衡
C.pH由8~11时,c(CO32-)·c(H+)/c(HCO3-)不变
D.pH=3时,有c(NH4+)+c(NH3·H2O) =c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列晶体熔化:NaOH、SiO2、CaO、CCl4,需要克服的微粒间的相互作用①共价键②离子键③分子间作用力,正确的顺序是
A.②①②③B.①②②③C.②③②①D.①①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名与化学式相对应的是( )
A.碳铵﹣﹣NH4HCO3
B.生石灰 Ca(OH)2
C.石膏﹣﹣CaSO3
D.酒精 CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因离子间彻底双水解不能在溶液中大量共存的一组离子是( )
A.Ag+、NH ![]() 、PO
、PO ![]() 、Cl﹣
、Cl﹣
B.AlO ![]() 、K+、I﹣、HCO
、K+、I﹣、HCO ![]()
C.K+、Fe2+、NO ![]() 、[Fe(CN)6]3﹣
、[Fe(CN)6]3﹣
D.Na+、Fe3+、Cl﹣、AlO2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
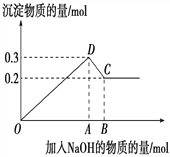
(1)写出代表下列线段发生的反应的离子方程式:
DC段________________________________________________。
(2)原溶液中Mg2+、Al3+的物质的量之比为_____________。
(3)图中B点时所加入溶液中含NaOH为________mol
(4)若向50 mL 2 mol·L-1的AlCl3溶液中加入100 mL KOH溶液,充分反应后得到3.12g沉淀。则KOH的物质的量浓度可能为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com