
【题目】下列物质俗名与化学式对应错误的是
A.胆矾 CuSO45H2O
B.重晶石 BaSO3
C.绿矾 FeSO47H2O
D.明矾KAl(SO4)212H2O
科目:高中化学 来源: 题型:
【题目】下表是中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题.
族 | IA | 0 | |||||||
1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
2 | ② | ③ | ⑥ | Ne | |||||
3 | ④ | ⑤ | Al | S | |||||
(1)⑥表示的元素是;
(2)②的原子结构示意图是;
(3)由①和③两种元素组成的化合物的化学式是;
(4)④和⑤两种元素的金属性强弱顺序是④⑤(填“<”或“>”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含氧酸盐X的化学式为ABO3 ;已知在元素周期表中,A、B均为前四周期主族元素,且A位于B的下一周期。
(1)若常温下A、B的单质都能与水发生反应,且A的焰色反应为紫色。
①B在元素周期表中的位置是___________________。
②下列说法正确的是__________(填代号)。
a.A离子的半径大于B离子的半径
b.A、B元素的最高价氧化物对应的水化物都是强电解质
c.A单质与水反应后溶液的pH比B单质与水反应后溶液的pH大
③400℃时,X能发生分解反应生成两种盐,其物质的量之比为1:3,其中一种是无氧酸盐。该反应的化学方程式为_______________________________________________。
(2)若含氧酸盐X难溶于水,在空气中易氧化变质;且B元素原子的最外层电子数是其电子层数的2倍。已知X能快速消除自来水中的C1O—,则该反应的离子方程式为_____________
(3)若含氧酸盐X能与稀硫酸反应,生成无色、无味的气体。
①该气体的电子式为______________。
②X可用作防火涂层,其原因是:
a.高温下X发生分解反应时,吸收大量的热;b.________________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列各项结构的规律,按此规律排布第10项的分子式应为( ) 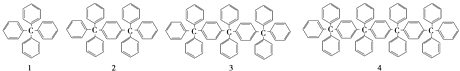
A.C198H146
B.C196H155
C.C196H146
D.C198H155
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无土栽培中,须配制一定量含50molNH4Cl、16molKCl和24molK2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体来配制,三者的物质的量依次是(单位:mol):
A.2、64、24B.64、2、24
C.32、50、12D.16、50、24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,实验测得1.0mol/LNH4HCO3溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是( )
A.常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B.pH=13时,溶液中不存在HCO3-的水解平衡
C.pH由8~11时,c(CO32-)·c(H+)/c(HCO3-)不变
D.pH=3时,有c(NH4+)+c(NH3·H2O) =c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 利用丁达尔效应可以区分溶液和胶体
B. 胶体的分散质粒子直径大于1nm小于100nm,但不能通过半透膜
C. PM2.5是指大气中直径接近于2.5×10-6 m(1m=109 nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体
D. 溶液的分散质粒子直径小于1nm,能通过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为( )
A. 10mol B. 11mol C. 12mol D. 13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为:
![]()
根据题意回答:
(1)现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入_____g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4;
(2)如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液____mL;
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为_______;
(4)有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为:![]() ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为___________________。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com