
【题目】100mL某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,会产生H2;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.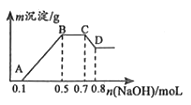
则:
(1)溶液中一定含有的阳离子有 , 一定不含有的离子有 .
(2)C→D的离子方程式为 .
(3)由A→B及C→D段有关数据可计算出的某两种离子的物质的量浓度分别为molL﹣1和molL﹣1 .
【答案】
(1)H+、NH4+、Mg2+、Al3+;CO32﹣、NO3﹣、Fe3+
(2)Al(OH)3+OH﹣=AlO2﹣+2H2O
(3)1;0.5
【解析】根据①可知,溶液显酸性,则溶液中一定不存在CO32﹣和NO3﹣;根据②可知,产生的是白色沉淀,说明不存在Fe3+;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+ , 根据溶液电中性可知,溶液中一定存在阴离子SO42﹣;即一定含有:H+、NH4+、Mg2+、Al3+、SO42﹣ , 一定不含CO32﹣、NO3﹣、Fe3+ . (1)溶液中一定含有的阳离子有H+、NH4+、Mg2+、Al3+; 一定不含有的离子有CO32﹣、NO3﹣、Fe3+;故答案为:H+、NH4+、Mg2+、Al3+;CO32﹣、NO3﹣、Fe3+;
(2)C→D的反应为氢氧化铝溶于氢氧化钠,其离子方程式为Al(OH)3+OH﹣=AlO2﹣+2H2O;故答案为:Al(OH)3+OH﹣=AlO2﹣+2H2O;
(3)根据图像可知,A→B为Mg2+、Al3+与氢氧化钠反应,消耗氢氧化钠为0.5mol﹣0.1mol=0.4mol,C→D阶段为氢氧化钠溶解氢氧化铝:Al(OH)3+OH﹣=AlO2﹣+2H2O,消耗氢氧化钠0.8mol﹣0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知n(Al3+)=0.1mol;则c(Al3+)= ![]() =1mol/L;与镁离子反应的氢氧化钠为0.4mol﹣0.1mol×3=0.1mol,则n[Mg(OH)2]=0.05mol,则则c(Mg2+)=
=1mol/L;与镁离子反应的氢氧化钠为0.4mol﹣0.1mol×3=0.1mol,则n[Mg(OH)2]=0.05mol,则则c(Mg2+)= ![]() =0.5mol/L;故答案为:1;0.5根据①可知,溶液显酸性,则溶液中一定不存在CO32﹣和NO3﹣;根据②可知,产生的是白色沉淀,说明不存在Fe3+;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+ , 根据溶液电中性可知,溶液中一定存在阴离子SO42﹣;即一定含有:H+、NH4+、Mg2+、Al3+、SO42﹣ , 一定不含CO32﹣、NO3﹣、Fe3+ , 据此解答即可.
=0.5mol/L;故答案为:1;0.5根据①可知,溶液显酸性,则溶液中一定不存在CO32﹣和NO3﹣;根据②可知,产生的是白色沉淀,说明不存在Fe3+;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+ , 根据溶液电中性可知,溶液中一定存在阴离子SO42﹣;即一定含有:H+、NH4+、Mg2+、Al3+、SO42﹣ , 一定不含CO32﹣、NO3﹣、Fe3+ , 据此解答即可.


科目:高中化学 来源: 题型:
【题目】常温下,实验测得1.0mol/LNH4HCO3溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是( )
A.常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B.pH=13时,溶液中不存在HCO3-的水解平衡
C.pH由8~11时,c(CO32-)·c(H+)/c(HCO3-)不变
D.pH=3时,有c(NH4+)+c(NH3·H2O) =c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠投入滴有石蕊的水中,下列有关现象的叙述中错误的是
A. 钠浮在液面上 B. 有气体产生
C. 水溶液变为红色 D. 钠熔成小球并在水面四处游动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g) ![]() R(g)+Q(g)的平衡常数与温度的关系如表.830℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005mol/(Ls).下列说法正确的是( )
R(g)+Q(g)的平衡常数与温度的关系如表.830℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005mol/(Ls).下列说法正确的是( )
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A.4s时容器内c(Y)=0.76 mol/L
B.830℃达平衡时,X的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为:
![]()
根据题意回答:
(1)现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入_____g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4;
(2)如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液____mL;
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为_______;
(4)有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为:![]() ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为___________________。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
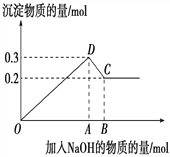
(1)写出代表下列线段发生的反应的离子方程式:
DC段________________________________________________。
(2)原溶液中Mg2+、Al3+的物质的量之比为_____________。
(3)图中B点时所加入溶液中含NaOH为________mol
(4)若向50 mL 2 mol·L-1的AlCl3溶液中加入100 mL KOH溶液,充分反应后得到3.12g沉淀。则KOH的物质的量浓度可能为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A.过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌
B.用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干
C.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。这里用到的实验方法可用于分离
A.苯和水B.乙醇和水C.食盐水和泥沙D.硝酸钾和硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。

Ⅰ.海水所得粗盐中含Ca2+、Mg2+、SO![]() - 等杂质,为了有效除去Ca2+、Mg2+、SO
- 等杂质,为了有效除去Ca2+、Mg2+、SO![]() -,加入试剂的合理顺序为___________。
-,加入试剂的合理顺序为___________。
A.先加NaOH,后加Na2CO3,再加Ba2+试剂
B.先加NaOH,后加Ba2+试剂,再加Na2CO3
C.先加Ba2+试剂,后加NaOH,再加Na2CO3
要除去SO![]() -,必须添加钡试剂,该钡试剂可以是___________。
-,必须添加钡试剂,该钡试剂可以是___________。
A.Ba(OH)2 B. Ba(NO3)2 C.BaCl2
Ⅱ.写出用Ca(OH)2制取氢氧化镁的化学方程式:_____________________。
从经济效益角度看,该化工厂的厂址应选择在__________________。
(2)海藻中提取碘的流程如图:
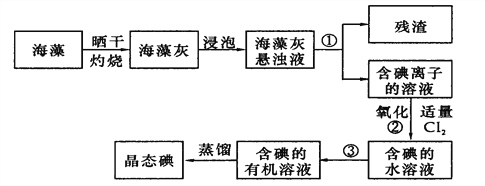
指出提取碘的过程中有关实验操作名称:①__________,③__________;
写出过程②中有关反应的离子方程式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com