
【题目】(1)从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。

Ⅰ.海水所得粗盐中含Ca2+、Mg2+、SO![]() - 等杂质,为了有效除去Ca2+、Mg2+、SO
- 等杂质,为了有效除去Ca2+、Mg2+、SO![]() -,加入试剂的合理顺序为___________。
-,加入试剂的合理顺序为___________。
A.先加NaOH,后加Na2CO3,再加Ba2+试剂
B.先加NaOH,后加Ba2+试剂,再加Na2CO3
C.先加Ba2+试剂,后加NaOH,再加Na2CO3
要除去SO![]() -,必须添加钡试剂,该钡试剂可以是___________。
-,必须添加钡试剂,该钡试剂可以是___________。
A.Ba(OH)2 B. Ba(NO3)2 C.BaCl2
Ⅱ.写出用Ca(OH)2制取氢氧化镁的化学方程式:_____________________。
从经济效益角度看,该化工厂的厂址应选择在__________________。
(2)海藻中提取碘的流程如图:
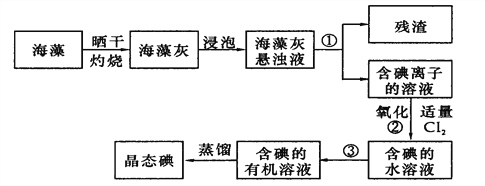
指出提取碘的过程中有关实验操作名称:①__________,③__________;
写出过程②中有关反应的离子方程式____________________________。
【答案】BCACMgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2海边过滤萃取分液Cl2+2I-=I2+2Cl-
【解析】
(1)I.有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然选项BC符合,故答案为BC;
要除去SO![]() -,必须添加钡试剂,同时考虑不引入杂质离子,该钡试剂可以是Ba(OH)2 和BaCl2,不能用Ba(NO3)2 ,因为引入的NO3-无法除去,故答案为AC;
-,必须添加钡试剂,同时考虑不引入杂质离子,该钡试剂可以是Ba(OH)2 和BaCl2,不能用Ba(NO3)2 ,因为引入的NO3-无法除去,故答案为AC;
Ⅱ.海水中的MgCl2与加入的Ca(OH)2反应可得到氢氧化镁,反应的化学方程式为MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;从经济效益角度看,该化工厂的厂址应选择在海边,可直接利用海水,减少运输成本;
(2)分离固体和液体用过滤,利用溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把溶质从它跟另一种溶剂所组成的溶液里提取出来,这种方法叫做萃取,③将碘水中的碘单质萃取出来,互不相溶的物质的分离是分液法;过程②用氯气氧化I-生成I2,发生反应的离子方程式为 Cl2+2I-=I2+2Cl-。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)![]() HCOOH(g) 测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数( )
HCOOH(g) 测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数( )

A、①② B、①③
C、②④ D、③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组是( )
A. 含有大量Mg2+的溶液:Na+、NH4+、SO![]() -、Cl-
-、Cl-
B. 碱性溶液:Na+、Ca2+、SO![]() -、CO
-、CO![]() -
-
C. 含有大量Fe3+的溶液:Na+、Mg2+、NO![]() 、SCN-
、SCN-
D. 含有大量NO![]() 的溶液:H+、Fe2+、SO
的溶液:H+、Fe2+、SO![]() -、Cl-
-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol·L-1、体积均为V0的MOH与ROH溶液,分别加水稀释至体积V,pH随lg(V/ V0)的变化如图所示,下列叙述错误的是( )
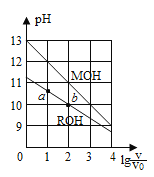
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg(V/ V0))=2时,若两溶液同时升高温度,则c(M+)/c(R+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与1.8 g H2O 含有相同氢原子数的 H2SO4 是( )
A. 9.8 g B. 19.6 g
C. 0.15 mol D. 0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.含有共价键的化合物一定是共价化合物
B.Na2O2中既含有离子键又含有非极性共价键
C.KOH中只含有共价键
D.KI和HI中化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸反应
B.灼热的炭与水蒸气的反应
C.Ba(OH)28H2O与NH4Cl反应
D.甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室可以用二氧化锰和浓盐酸反应制取氯气,方程式如下:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,下图是某学生设计的试验室制备干燥Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题:
MnCl2+Cl2↑+2H2O,下图是某学生设计的试验室制备干燥Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题:
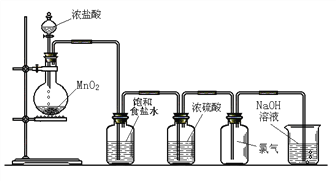
(1)该实验中还缺少一种仪器,这种仪器是_____________;
(2)饱和食盐水的作用是____________________;
(3)氯气与冷的氢氧化钠溶液反应生成NaCl、NaClO和H2O,与热的氢氧化钠溶液按照下面的反应进行:____________________
Cl2+ NaOH(热) - NaCl+ NaClO3+ H2O,请配平上述反应方程式;
(4)8.7 g MnO2和足量的浓盐酸反应,其中被氧化的HCl的物质的量为_________mol。
Ⅱ.某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验。
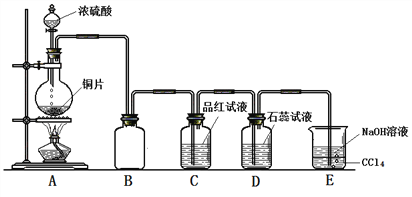
(1)B是用来收集实验中生成的气体的装置,但未将导管画全,请把导管补充完整_____________;
(2)D中的现象是_____________________;
(3)E中NaOH溶液的作用是_________________;
(4)下列药品中能够用来验证反应停止后的烧瓶中有H2SO4剩余的是__________(填字母编号)。
a.BaCl2溶液 b.NaHCO3粉末 c.Ba(NO3)2溶液 d.银粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为________,Ba2+的物质的量为_______。
II.把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6 LH2(标准状况下)。
(1)合金中镁的物质的量_________。
(2)写出该合金溶于足量NaOH溶液的化学方程式_________。同时产生H2的体积(标准状况下)为____________ 。
III.在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则:

①生成Mg(OH)2的质量为__________;
②X=_______;Y=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com