
【题目】I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为________,Ba2+的物质的量为_______。
II.把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6 LH2(标准状况下)。
(1)合金中镁的物质的量_________。
(2)写出该合金溶于足量NaOH溶液的化学方程式_________。同时产生H2的体积(标准状况下)为____________ 。
III.在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则:

①生成Mg(OH)2的质量为__________;
②X=_______;Y=_________。
【答案】0.2 mol L-10.002 mol0.1 mol2Al+2NaOH+2H2O=2NaAlO2+3H2↑3.36 L5.8 g0.50.6
【解析】本题考查物质的量及物质的量浓度的有关计算,注意根据图像和化学方程式的比例关系计算。
I.根据电离方程式,BaCl2=Ba2++2Cl-,20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol·L-1,Ba2+的物质的量为0.02L×0.1mol/L=0.002mol。
II.(1)设合金中Mg的物质的量为xmol,铝的物质的量为ymol,根据得失电子守恒可列方程2x+3y=5.6L÷22.4L/mol×2,根据两者的质量和为5.1g可列方程24x+27y=5.1,解方程得:x=0.1mol,y=0.1mol。
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据化学方程式可知,0.1mol铝完全反应产生0.15mol氢气,0.15mol氢气在标准状况下的体积为0.15mol×22.4L/mol=3.36L。
III.①由图像可知,氢氧化镁和氢氧化铝沉淀的物质的量和为0.2mol,向沉淀中加入NaOH后,只有氢氧化铝和NaOH反应导致沉淀物质的量减少,不溶的0.1mol是氢氧化镁,所以生成氢氧化镁的质量为0.1mol×58g/mol=5.8g。
②根据离子反应:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,Al(OH)3 +OH- =AlO2- +2H2O,0.1mol镁离子消耗氢氧化钠0.2mol,0.1mol铝离子消耗氢氧化钠0.3mol,所以X=0.2+0.3=0.5mol,溶解氢氧化铝消耗氢氧化钠0.1mol,则Y=0.5+0.1=0.6mol。


科目:高中化学 来源: 题型:
【题目】(1)从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。

Ⅰ.海水所得粗盐中含Ca2+、Mg2+、SO![]() - 等杂质,为了有效除去Ca2+、Mg2+、SO
- 等杂质,为了有效除去Ca2+、Mg2+、SO![]() -,加入试剂的合理顺序为___________。
-,加入试剂的合理顺序为___________。
A.先加NaOH,后加Na2CO3,再加Ba2+试剂
B.先加NaOH,后加Ba2+试剂,再加Na2CO3
C.先加Ba2+试剂,后加NaOH,再加Na2CO3
要除去SO![]() -,必须添加钡试剂,该钡试剂可以是___________。
-,必须添加钡试剂,该钡试剂可以是___________。
A.Ba(OH)2 B. Ba(NO3)2 C.BaCl2
Ⅱ.写出用Ca(OH)2制取氢氧化镁的化学方程式:_____________________。
从经济效益角度看,该化工厂的厂址应选择在__________________。
(2)海藻中提取碘的流程如图:
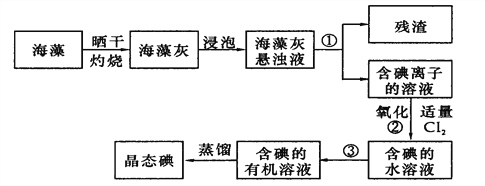
指出提取碘的过程中有关实验操作名称:①__________,③__________;
写出过程②中有关反应的离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,下列说法正确的是( )
A. 所含分子数和质量均不相同]
B. 含有相同的分子数和电子数
C. 含有相同的质子数和中子数
D. 含有相同数目的中子、原子和分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是( )
A.利用金属钠或者金属钾
B.利用质谱法
C.利用红外光谱法
D.利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空:
(1)0. 5 mol NH3分子中所含氮原子数为__________个;
(2)1.2g RSO4中含0.01 mol R2+,则RSO4的摩尔质量是__________;
(3)0.1 mol·L-1的 Cu(NO3)2溶液中NO3-的物质的量浓度是__________;
(4)新制氯水在阳光照射下产生的无色气体是__________;
(5)配制100 mL 1 mol/L NaCl溶液,定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补加水至刻度处,会引起所配溶液物质的量浓度__________(选填“偏高、偏低、无影响”);
(6)实验室制备氯气时,收集氯气常采用__________法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应A(g)+B(g) ![]() C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。
C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。

①图中该反应是_________反应(填“吸热”、“放热”)。反应热△H的表达式为__________。
②在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2_________(填“增大”、“减小”或“不变”)
(2)丙烷是一种价格低廉的常用燃料,其主要成分是碳和氢两种元素,燃烧后只有二氧化碳和气态水,不会对环境造成污染。已知1 g丙烷完全燃烧放出50.45 kJ的热量。试回答下列问题。丙烷在室温下燃烧的热化学方程式为_______________。
(3)C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ·mol-1;
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ·mol-1。
则相同条件下,反应:C3H8(g)→CH3CH=CH2(g)+H2(g)的△H= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.2mol/LH2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示。根据图示判断,下列说法正确的是
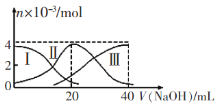
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B.等浓度的NaOH溶液与H2A溶液按体积2:1混合后,其溶液中水的电离程度比纯水大
C.NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A)
D.向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com