
【题目】与1.8 g H2O 含有相同氢原子数的 H2SO4 是( )
A. 9.8 g B. 19.6 g
C. 0.15 mol D. 0.2 mol
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】向一定量Fe、FeO、Fe2O3的混合物中,加入50mL1mol·L-1硫酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为
A. 11.2g B. 2.8g C. 5.62g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要使相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中所含SO42-的数目相同,则所取两溶液的体积比是
A.3∶1 B.1∶3 C.3∶2 D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题:

(1)A所含元素在周期表中的位置为 C的电子式为
(2)A与H在加热条件下反应的离子方程式为
(3)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为 I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为
(4)向含有0.4mol F、0.1 mol G的混合溶液中加入过量盐酸,完全反应后收集到a L气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。

Ⅰ.海水所得粗盐中含Ca2+、Mg2+、SO![]() - 等杂质,为了有效除去Ca2+、Mg2+、SO
- 等杂质,为了有效除去Ca2+、Mg2+、SO![]() -,加入试剂的合理顺序为___________。
-,加入试剂的合理顺序为___________。
A.先加NaOH,后加Na2CO3,再加Ba2+试剂
B.先加NaOH,后加Ba2+试剂,再加Na2CO3
C.先加Ba2+试剂,后加NaOH,再加Na2CO3
要除去SO![]() -,必须添加钡试剂,该钡试剂可以是___________。
-,必须添加钡试剂,该钡试剂可以是___________。
A.Ba(OH)2 B. Ba(NO3)2 C.BaCl2
Ⅱ.写出用Ca(OH)2制取氢氧化镁的化学方程式:_____________________。
从经济效益角度看,该化工厂的厂址应选择在__________________。
(2)海藻中提取碘的流程如图:
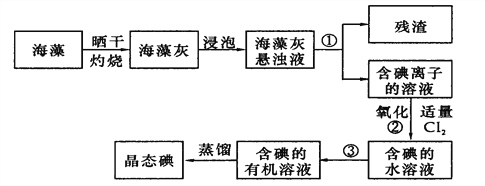
指出提取碘的过程中有关实验操作名称:①__________,③__________;
写出过程②中有关反应的离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏伽德罗常数) ( )
A.24g镁单质变为镁离子时,失去的电子数为NA
B.48.3gNa2SO4·10H2O中所含水分子的数目为0.15NA个
C.18g水所含的电子数为NA
D.3.2g氧气所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.标准状况下,11.2L二氯甲烷所含分子数为0.5NA
D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空:
(1)0. 5 mol NH3分子中所含氮原子数为__________个;
(2)1.2g RSO4中含0.01 mol R2+,则RSO4的摩尔质量是__________;
(3)0.1 mol·L-1的 Cu(NO3)2溶液中NO3-的物质的量浓度是__________;
(4)新制氯水在阳光照射下产生的无色气体是__________;
(5)配制100 mL 1 mol/L NaCl溶液,定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补加水至刻度处,会引起所配溶液物质的量浓度__________(选填“偏高、偏低、无影响”);
(6)实验室制备氯气时,收集氯气常采用__________法。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com