
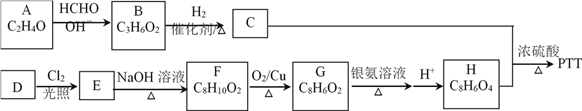
ЁОЬтФПЁПИпЗжзгЛЏКЯЮяPTTЪЧвЛжжадФмгХвьЕФаТаЭЯЫЮЌЁЃPTTЕФвЛжжКЯГЩТЗЯпШчЯТЭМЃК
вбжЊЃК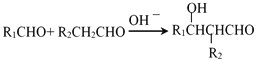 ЃЈ
ЃЈ![]() ЃЉ
ЃЉ
ЃЈ1ЃЉвбжЊAЗжзгжагаСНжжВЛЭЌЛЏбЇЛЗОГЕФЧтдзгЃЌЪ§ФПБШЮЊ1:3ЃЌдђAЕФНсЙЙМђЪНЮЊ______ЁЃ
ЃЈ2ЃЉгЩBЩњГЩCЕФЗДгІРраЭЮЊ______ЃЌCЮяжЪЕФЛЏбЇУћГЦЮЊ______ЁЃ
ЃЈ3ЃЉЗМЯуЬўDЕФЯрЖдЗжзгжЪСПЮЊ106ЃЌDЕФвЛТШДњЮяжЛга2жжЃЌдђDЕФНсЙЙМђЪНЮЊ______ЁЃ
ЃЈ4ЃЉгЩEЩњГЩFЕФЗДгІРраЭЮЊ______ЁЃ
ЃЈ5ЃЉGЗжзгЫљКЌЙйФмЭХУћГЦЮЊ______ЁЃ
ЃЈ6ЃЉаДГіКЯГЩPTTЕФЛЏбЇЗНГЬЪН______ЁЃ
ЃЈ7ЃЉгаЛњЮяHЕФЭЌЗжвьЙЙЬхгаКмЖржжЃЌаДГіЗћКЯЯТСаЬѕМўЕФвЛжжЭЌЗжвьЙЙЬхНсЙЙМђЪН______ЁЃ
ЂйКЌгаБНЛЗ ЂкКЫДХЙВеёЧтЦзгаШ§ИіЗх
ЁОД№АИЁП CH3CHO МгГЩЃЈЛђЛЙдЃЉ 1ЃЌ3-БћЖўДМ  ШЁДњ ШЉЛљ
ШЁДњ ШЉЛљ ![]()

ЁОНтЮіЁП(1)ИљОнAЁњBЕФзЊЛЏаХЯЂКЭвбжЊЬѕМўЃЌМДПЩШЗЖЈAЕФНсЙЙМђЪНЮЊCH3CHOЃЛ
(2) гЩBЩњГЩCЪЧдкДпЛЏМСзїгУЯТгыЧтЦјЗЂЩњМгГЩЗДгІЃЌЙЪЗДгІРраЭЮЊМгГЩЗДгІЃЈЛђЛЙдЗДгІЃЉЃЛCЕФУћГЦЮЊ1ЃЌ3-БћЖўДМЃЛ
(3)вбжЊЗМЯуЬўDЕФЯрЖдЗжзгжЪСПЮЊ106ЃЌDЕФвЛТШДњЮяжЛга2жжЃЌМДБНЛЗЩЯвЛжжЃЌШЁДњЛљЩЯвЛжжЃЌдђШЁДњЛљБиаыЪЧЯрЭЌЕФЃЌЧвДІгкБНЛЗЩЯЕФЖдГЦЮЛжУЃЌЫљвдDЕФНсЙЙМђЪНЮЊ![]()
(4)DдкТШЦјДцдкЯТЙтееЃЌЗЂЩњШЁДњЗДгІЩњГЩЖўТШДњЬўEЃЌЖјEдкNaOHШмвКжаЫЎНтЩњГЩЖўдЊДМFЃЌЫљвдEЩњГЩFЕФЗДгІРраЭЮЊШЁДњЗДгІЃЛ
(5)ЖўдЊДМFдкДпЛЏМСCuЕФзїгУЯТбѕЛЏЩњГЩЖўдЊШЉGЃЌЛђепGФмЗЂЩњвјОЕЗДгІЃЌЫљвдGжаКЌгаЕФЙйФмЭХЕФУћГЦЮЊШЉЛљЃЛ
(6)гЩЖўдЊДМCКЭЖўдЊЫсHЗЂЩњЫѕОлЗДгІЩњГЩPTTЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ
(7) HЕФЭЌЗжвьЙЙЬхжаКЌгаБНЛЗЧвКЫДХЙВеёЧтЦзгаШ§ИіЗхЃЌЫљвдБиаыДгБНЛЗЩЯСЌНгЕФШЁДњЛљЮЛжУЖдГЦЃЌЧвШЁДњЛљЯрЭЌЕФНЧЖШШЅЫМПМЃЌЫљвдЗћКЯвЊЧѓЕФНсЙЙМђЪНга![]() 0
0 ЕШЃЌШЮаДвЛИіМДПЩЁЃ
ЕШЃЌШЮаДвЛИіМДПЩЁЃ


 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаа№Ъіе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
A.1molCO2ЕФжЪСПЮЊ44gmolЉ1
B.ЙЬЬхЛђвКЬхЮяжЪЕФЬхЛ§жївЊОіЖЈгкЮЂСЃИіЪ§МАЮЂСЃжЎМфЕФЦНОљОрРы
C.SO42ЉЕФФІЖћжЪСПЮЊ96g
D.O2ЕФФІЖћжЪСПЮЊ32gmolЉ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкШчЭМЫљЪОзАжУжа,ЙлВьЕНЕчСїМЦжИеыЦЋзЊ,MАєБфДж,NАєБфЯИ,ЦфжаPЮЊЕчНтжЪШмвКЁЃгЩДЫХаЖЯMЁЂNЁЂPЫљДњБэЕФЮяжЪПЩФмЪЧ( )

A. A B. B C. C D. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТБэЪЧ25 ЁцЪБФГаЉШѕЫсЕФЕчРыЦНКтГЃЪ§ЁЃ
ЛЏбЇЪН | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | KaЃН1.8ЁС10Ѓ5 | KaЃН3.0ЁС10Ѓ8 | Ka1ЃН4.1ЁС10Ѓ7 | Ka1ЃН5.9ЁС10Ѓ2 |
ЃЈ1ЃЉH2C2O4гыКЌЕШЮяжЪЕФСПЕФKOHЕФШмвКЗДгІКѓЫљЕУШмвКГЪЫсадЃЌИУШмвКжаИїРызгХЈЖШгЩДѓЕНаЁЕФЫГађЮЊЁЃ
ЃЈ2ЃЉЯђ0.1 molЁЄLЃ1 CH3COOHШмвКжаЕЮМгNaOHШмвКжСcЃЈCH3COOHЃЉЁУcЃЈCH3COOЃЃЉЃН5ЁУ9ЃЌДЫЪБШмвКpHЃНЁЃ
ЃЈ3ЃЉЯђЬМЫсФЦШмвКжаЕЮМгЩйСПТШЫЎЕФРызгЗНГЬЪНЮЊЁЃ
ЃЈ4ЃЉШє0.1molЁЄLЃ1CH3COOHШмвКгы0.1molЁЄLЃ1NaOHШмвКЕШЬхЛ§ЛьКЯЃЈКіТдЛьКЯКѓШмвКЬхЛ§ЕФБфЛЏЃЉЃЌВтЕУЛьКЯШмвКЕФpHЃН8ЃЌдђcЃЈNa+ЃЉ-cЃЈCH3COOЃЃЉ=molЁЄLЃ1ЃЈЬюОЋШЗМЦЫуНсЙћЃЉЁЃ
ЃЈ5ЃЉНЋCH3COOHШмвКгыДѓРэЪЏЗДгІЫљВњЩњЕФБъПіЯТ44.8LЦјЬхШЋВПЭЈШыЕН2L 1.5mol/LЕФNaOHШмвКжаГфЗжЗДгІЃЌдђШмвКжаЫљгаРызгЕФЮяжЪЕФСПХЈЖШгЩДѓЕНаЁЕФЫГађЮЊЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПAs2O3дквНвЉЁЂЕчзгЕШСьгђгаживЊгІгУЁЃФГКЌЩщдЊЫи(As)ЕФЙЄвЕЗЯЫЎОШчЯТСїГЬзЊЛЏЮЊДжAs2O3ЁЃ
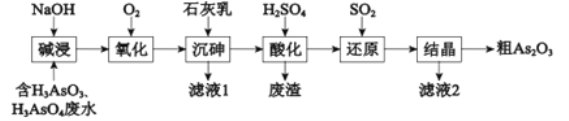
ЃЈ1ЃЉЁАМюНўЁБЕФФПЕФЪЧНЋЗЯЫЎжаЕФH3AsO3КЭH3AsO4зЊЛЏЮЊбЮЃЎH3AsO4зЊЛЏЮЊNa3AsO4ЗДгІЕФЛЏбЇЗНГЬЪНЪЧ__________ЃЎ
ЃЈ2ЃЉЁАбѕЛЏЁБЪБЃЌ1molAsO33-зЊЛЏЮЊAsO43-жСЩйашвЊO2___________ЃЎ
ЃЈ3ЃЉЁАГСЩщЁБЪЧНЋЩщдЊЫизЊЛЏЮЊCa5ЃЈAsO4ЃЉ3OHГСЕэЃЌЗЂЩњЕФжївЊЗДгІгаЃК
aЃЎCaЃЈOHЃЉ2ЃЈsЃЉ![]() Ca2+ЃЈaqЃЉ+2OH-ЃЈaqЃЉЁїHЃМ0
Ca2+ЃЈaqЃЉ+2OH-ЃЈaqЃЉЁїHЃМ0
bЃЎ5Ca2++OH-+3AsO43-![]() Ca5ЃЈAsO4ЃЉ3OH ЁїHЃО0
Ca5ЃЈAsO4ЃЉ3OH ЁїHЃО0
баОПБэУїЃКЁАГСЩщЁБЕФзюМбЮТЖШЪЧ85ЁцЃЎИпгк85ЁцКѓЃЌЫцЮТЖШЩ§Ип,ГСЕэТЪ________(ЬюЁАЬсИпЁБЛђЁАЯТНЕЁБ)ЁЃгУЛЏбЇЦНКтдРэНтЪЭЦфдвђЪЧ_________ЁЃ
ЃЈ4ЃЉЁАЛЙдЁБЙ§ГЬжаH3AsO4зЊЛЏЮЊH3AsO3ЃЌЗДгІЕФЛЏбЇЗНГЬЪНЪЧ_________ЃЎ
ЃЈ5ЃЉЁАЛЙдЁБКѓМгШШШмвКЃЌH3AsO3ЗжНтЮЊAs2O3ЃЌЭЌЪБНсОЇЕУЕНДжAs2O3ЃЎAs2O3дкВЛЭЌЮТЖШКЭВЛЭЌХЈЖШСђЫсжаЕФШмНтЖШЃЈSЃЉЧњЯпШчгвЭМЫљЪОЃЎЮЊСЫЬсИпДжAs2O3ЕФГСЕэТЪЃЌЁАНсОЇЁБЙ§ГЬНјааЕФВйзїЪЧ___________ЃЎ
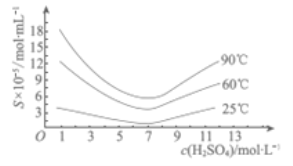
ЃЈ6ЃЉЯТСаЫЕЗЈжаЃЌе§ШЗЕФЪЧ__________ЃЈЬюзжФИЃЉЃЎ
a.ДжAs2O3жаКЌгаCaSO4
b.ЙЄвЕЩњВњжаЃЌТЫвК1ЁЂ2КЭЗЯдќвЛЭЌЦњЕє
c.ЭЈЙ§ЯШЁАГСЩщЁБКѓЁАЫсЛЏЁБЕФЫГађЃЌПЩвдДяЕНИЛМЏЩщдЊЫиЕФФПЕФ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЮЊЗДгІ2H2ЃЈgЃЉ+O2ЃЈgЃЉЈT2H2OЃЈgЃЉЕФФмСПБфЛЏЪОвтЭМЃЎЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ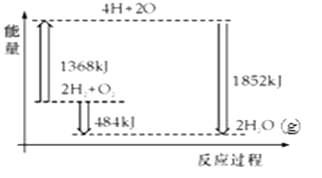
A.H2ЃЈgЃЉКЭO2ЃЈgЃЉЗДгІЩњГЩH2OЃЈg ЃЉЃЌетЪЧЮќШШЗДгІ
B.2mol H2КЭ1mol O2зЊЛЏЮЊ4mol HЁЂ2mol OдзгЕФЙ§ГЬжаЗХГіШШСП
C.2mol H2ЃЈgЃЉКЭ1mol O2ЃЈgЃЉЗДгІЩњГЩ2mol H2OЃЈgЃЉЃЌЙВЗХГі484kJФмСП
D.4mol HЁЂ2mol OЩњГЩ2mol H2OЃЈgЃЉЃЌЙВЗХГі484kJФмСП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШщЫсБЁКЩѕЅМђГЦMLЃЌПЩЬэМгЕНбРИрЁЂПкЯуЬЧЁЂвћСЯЕШжаЃЌгаГЄаЇЕФЧхСЙаЇЙћЃЌЦфНсЙЙМђЪНШчЯТЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ

A. MLЕФЗжзгЪНЮЊЃКC13H28O3 B. 1mol MLЭъШЋЫЎНтФмЯћКФ2mol NaOH
C. MLЗЂЩњЯћШЅЗДгІЕФВњЮяжЛгавЛжжНсЙЙ D. MLЗжзгжаЕФЫљгаЬМдзгдкЭЌвЛЦНУцЩЯ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗћКХДњБэвЛаЉФмВуЛђФмМЖЕФФмСПЃЌЧыНЋЫќУЧАДФмСПгЩЕЭЕНИпЕФЫГађХХСаЁЃ
ЃЈ1ЃЉEKЁЂENЁЂELЁЂEMЃК______________ЁЃ
ЃЈ2ЃЉE3sЁЂE2sЁЂE4sЁЂE1sЃК____________ЁЃ
ЃЈ3ЃЉE4sЁЂE4dЁЂE4pЁЂE4fЃК____________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМзЭщЁЂМзДМЖМЪЧЧхНрФмдДЁЃ
ЃЈ1ЃЉвбжЊЯТСаШШЛЏбЇЗНГЬЪН
ЂйCO2(g)+3H2(g)=CH3OHЃЈgЃЉ +H2O (g)ЁїH= -49.0 kJ/mol
ЂкCH4(g)+2O2(g)=2H2O(g) +CO2(g) ЁїH= -802.3 kJ/mol
Ђл2H2(g)+O2(g)=2H2O(l) ЁїH=-571.6 kJ/mol
ЂмH2O(g)=H2O(l) ЁїH= -44.0 kJ-mol
дђCH4(g)+1/2O2(g)=CH3OH(g) ЁїH =____________ЁЃ
ЃЈ2ЃЉЙЄвЕЩЯКЯГЩМзДМЕФСэвЛжжЗНЗЈЪЧ2H2(g)+CO(g) ![]() CH3OH(g) ЁїHЁЃ
CH3OH(g) ЁїHЁЃ
вЛЖЈЮТЖШЯТдк3ИіЬхЛ§ОљЮЊ1.0 LЕФКуШнУмБеШнЦїжаЗЂЩњЩЯЪіЗДгІЃЌЯрЙиЮяРэСПМћЯТБэЃК
ШнЦї | ЮТЖШ/K | ЮяжЪЕФЦ№ЪМХЈЖШ/molL-1 | ЮяжЪЕФЦНКтХЈЖШ/mol.L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
ЂйИУЗДгІЕФЁїH______0(ЬюЁА>ЁБЛђЁА<ЁБ)ЁЃ
ЂкДяЕНЦНКтЪБЃЌШнЦїIжаc(CH3OH)_____0.16mol/L(ЬюЁА>ЁБ ЁА<ЁБ ЛђЁА=ЁБ)ЁЃ
Ђл400 K ЪБИУЗДгІЕФЦНКтГЃЪ§K=________ЁЃ
(3)ЮФЯзБЈЕРФГПЮЬтзщРћгУCO2ДпЛЏШБЛЏжЦМзЭщЕФбаОПЙ§ГЬШчЯТ:
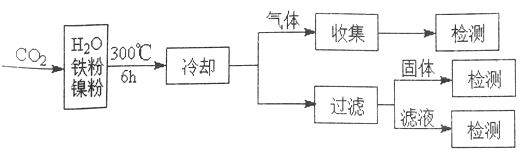
ЗДгІНсЪјКѓЃЌЦјЬхжаМьВтЕНCH4КЭH2ЃЌТЫвКжаМьВтЕНHCOOHЃЌЙЬЬхжаМьВтЕНФјЗлКЭFe3O4ЁЃCH4ЁЂHCOOHЁЂH2 ЕФВњСПКЭФјЗлгУСПЕФЙиЯЕШчЯТЭМЫљЪО(вЧИФБфФјЗлгУСПЃЌЦфЫћЬѕМўВЛБф)ЁЃбаОПШЫдБИљОнЪЕбщНсЙћЕУГіНсТл:HCOOH ЪЧCO2зЊЛЏЮЊCH4 ЕФжаМфЬхЃЌМД:![]()
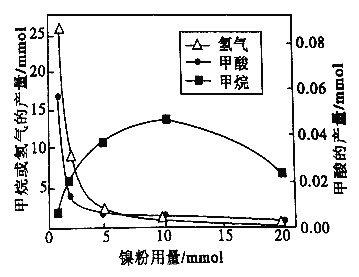
ЂйаДГіВњЩњH2ЕФЗДгІЗНГЬЪН_________ЁЃ
ЂкгЩЭМПЩжЊЃЌФјЗлЪЧ_______(ЬюзжФИ)ЁЃ
a.ЗДгІIЕФДпЛЏМС b.ЗДгІII ЕФДпЛЏМС
c.ЗДгІIКЭIIЕФДпЛЏМС d.ВЛЪЧДпЛЏМС
ЂлЕБФјЗлгУСПДг1mmolдіМгЕН10mmolЃЌЗДгІЫйТЪЕФБфЛЏЧщПіЪЧ______(ЬюзжФИ)ЁЃ
a.ЗДгІ1ЕФЫйТЪдіМгЃЌЗДгІIIЕФЫйТЪВЛБф
b.ЗДгІIЕФЫйТЪВЛБфЃЌЗДгІIIЕФЫйТЪдіМг
c.ЗДгІIЁЂIIЕФЫйТЪОљВЛБф
d.ЗДгІIЁЂIIЕФЫйТЪОљдіМгЃЌЧвЗДгІIЕФЫйТЪдіМгЕУПь
e.ЗДгІIЁЂIIЕФЫйТЪОљдіМгЃЌЧвЗДгІII ЕФЫйТЪдіМгЕУПь
f.ЗДгІIЕФЫйТЪМѕаЁЃЌЗДгІIIЕФЫйТЪдіМг
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com