
【题目】下列溶液中Cl—浓度最大的是
A.200mL2mol/L氯化钠溶液B.100mL1mol/L氯化铝溶液
C.500mL1mol/L氯化镁溶液D.100g液氯
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现在污水治理越来越引起人们重视,可以通过 ![]() 膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法正确的是.
膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法正确的是. 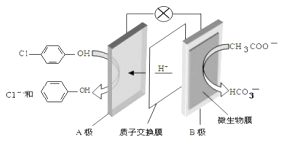
A.电流方向从B极沿导线经小灯泡流向A极
B.A极的电极反应式为 ![]() +e﹣═Cl﹣+
+e﹣═Cl﹣+ ![]()
C.当外电路中有0.2mole﹣转移时,通过质子交换膜的H+的个数为0.1NA
D.B极为电池的正极,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置.实验时,先断开K2 , 闭合K1 , 两极均有气泡产生;一段时间后,断开K1 , 闭合K2 , 发现电流表指针偏转,下列有关描述正确的是( ) 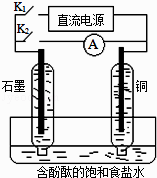
A.断开K2 , 闭合K1时,总反应的离子方程式为:2H++2Cl﹣ ![]() Cl2↑+H2↑
Cl2↑+H2↑
B.断开K2 , 闭合K1时,石墨电极附近溶液变红
C.断开K1 , 闭合K2时,铜电极上的电极反应为:Cl2+2e﹣=2Cl﹣
D.断开K1 , 闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校研究性学习小组用一些大部分已经锈蚀(成分为 Fe2O3)的废铁屑制备绿矾(FeSO4·7H2O),实验操作过程如下:

已知:杂质不溶于稀硫酸。
请回答下列问题:
(1)步骤①中,稀硫酸与 Fe2O3反应的离子方程式为 ______,废铁屑用硫酸处理后,还含有不溶性杂质,为获取澄清的A溶液,需进行的操作名称是 _________。
(2)步骤②中溶液A与铁粉反应的离子方程式为________________。
(3)检验溶液 B 中是否还存在杂质金属阳离子的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“吃尽百味还点盐,穿尽绫罗不如棉”。食盐不仅是调味品,更在医药、化工等领域有广泛应用。下列有关叙述中正确的是
A. 食盐熔化时因离子键遭破坏故属化学变化 B. 电解饱和食盐水可制备金属钠
C. 生理盐水的浓度越接近饱和药效越好 D. 加碘食盐中的碘以 IO3- 形成存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度为2mol/L的NaOH溶液的正确含义是 ( )
A. 在2L水中溶有80g NaOH B. 80g NaOH 溶于水配成的溶液
C. 每2L溶液中含有80g NaOH D. 每升溶液中含有80g NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+2H2(g)CH3OH(g)△H=﹣a kJmol﹣1 . ①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4molL﹣1、c(H2)=0.4molL﹣1、c(CH3OH)=0.8molL﹣1 , 则此时v正v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15min,用H2表示的平均反应速率为 , 达到平衡时CO的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现反应条件不同,反应速率不同。请回答下列问题:
(1)在用稀硫酸与锌制氢的实验中,加入少量下列物质可加快氢气生成速率的是_____(填序号)
A.Na2SO4 溶液 B.MgSO4 溶液 C.SO3 D.CuSO4 溶液
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
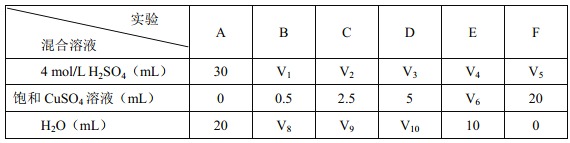
请完成此实验设计,其中:V1=____ mL, V6=______ mL。
该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析速率下降的主要原因__________ 。
(3)该同学为探究其它因素对锌与稀硫酸反应速率的影响,又做了以下实验,记录数据如下,回答下列问题:
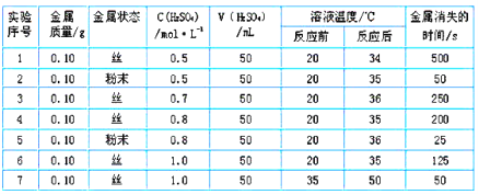
①由实验可推知,反应物的总能量_______产物的总能量(填“<”、 “>” 或“=”)。
②实验2和5表明,______对反应速率有影响。
③实验4和5表明,______对反应速率有影响,能表明同一规律的实验还有 _________ (填实验序号)。
④本实验中影响反应速率的其他因素还有________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com