
【题目】已知:CO(g)+2H2(g)CH3OH(g)△H=﹣a kJmol﹣1 . ①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4molL﹣1、c(H2)=0.4molL﹣1、c(CH3OH)=0.8molL﹣1 , 则此时v正v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15min,用H2表示的平均反应速率为 , 达到平衡时CO的转化率为 .
【答案】<;0.02mol?(L?min)﹣1;45%
【解析】解:①250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4molL﹣1、c(H2)=0.4molL﹣1、c(CH3OH)=0.8molL﹣1,浓度商Q= ![]() =12.5>K=2.041,说明反应逆向进行v正<v逆;
=12.5>K=2.041,说明反应逆向进行v正<v逆;
所以答案是:<;
②温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,15min,压强比(P后/P前)=0.80,则反应后气体的物质的量=3mol×0.80=2.40mol,气体减少的物质的量=3mol﹣2.4mol=0.6mol,根据气体减少的物质的量与氢气之间的关系式知,参加反应的氢气的物质的量= ![]() ×2=0.6mol,0~15min,用H2表示的平均反应速率=
×2=0.6mol,0~15min,用H2表示的平均反应速率= ![]() =0.02 mol( Lmin)﹣1;
=0.02 mol( Lmin)﹣1;
平衡状态压强比(P后/P前)=0.70,则反应后气体的物质的量=3mol×0.70=2.10mol,气体减少的物质的量=3mol﹣2.1mol=0.9mol,根据气体减少的物质的量与氢气之间的关系式知参加反应的CO的物质的量 ![]() =0.45mol,则CO的转化率=
=0.45mol,则CO的转化率= ![]() ×100%=45%,
×100%=45%,
所以答案是:0.02 mol( Lmin)﹣1;45%.
【考点精析】解答此题的关键在于理解反应速率的定量表示方法的相关知识,掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t,以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】研究化学反应时,既要考虑物质变化与能量变化,也要关注反应的快慢与限度。回答下列问题:
I.现有反应:①CaCO3=CaO+CO2↑,②Fe +H2SO4=FeSO4+ H2↑。
(1)两反应中属于吸热反应的是____(填序号)。
(2)Fe-Cu 原电池的装置如图所示。
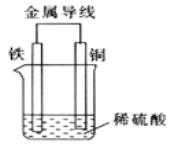
①溶液中H+向______(填“铁”或“铜” )电极方向移动。
②正极的现象是_______,负极的电极反应式为_________。
II.某可逆反应:2A(g)![]() B(g)+D(g)在3 种不同条件下进行,B和D的起始浓度均为0,反应物A 的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3 种不同条件下进行,B和D的起始浓度均为0,反应物A 的浓度随反应时间的变化情况如下表:
 (3)实验1中,在10~20 min内,以物质A表示的平均反应速率为_______mol/(L·min) ,50min时,v(正)______(填“<”“>”或“=”)v(逆)。
(3)实验1中,在10~20 min内,以物质A表示的平均反应速率为_______mol/(L·min) ,50min时,v(正)______(填“<”“>”或“=”)v(逆)。
(4)0~20min内,实验2 比实验1的反应速率______ (填“快”或“慢”),其原因可能是_______。
(5)实验3 比实验1的反应速率快,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3三种溶液中Cl—,消耗等物质的量浓度的AgNO3溶液的体积比为3:2:1,则上述三种溶液的体积比为
A. 6:3:2 B. 1:1:1 C. 9:3:1 D. 3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl—浓度最大的是
A.200mL2mol/L氯化钠溶液B.100mL1mol/L氯化铝溶液
C.500mL1mol/L氯化镁溶液D.100g液氯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构简式如图: 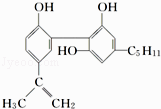
关于它的说法不正确的是( )
A.它的化学式为C20H24O3
B.从结构上看,它属于酚类
C.从结构上看,它属于醇类
D.从元素组成上看,它可以在氧气中燃烧生成CO2和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在冰晶石(Na3[AlF6])晶胞中,[AlF6]3﹣占据的位置相当于NaCl晶胞中Cl﹣占据的位置,则冰晶石晶胞中含有的原子数与NaCl晶胞中含有的原子数之比为( )
A.2:1
B.3:2
C.5:2
D.5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃的混合物9g,其密度是相同条件下氢气密度的11.25倍,当混合气体通过足量溴水时,溴水增重4.2g,则这两种气态烃是( )
A.甲烷和乙烯
B.乙烷和乙烯
C.甲烷和丙烯
D.甲烷和丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是 ( )
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸 ④加过量的碳酸钠溶液 ⑤加过量的氯化钡溶液
A.①④②⑤③B.④①②⑤③C.②⑤④①③D.⑤②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:K= ![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K增大
B.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应
C.增大压强,W(g)体积分数增加
D.增大X(g)浓度,平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com