
【题目】完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3三种溶液中Cl—,消耗等物质的量浓度的AgNO3溶液的体积比为3:2:1,则上述三种溶液的体积比为
A. 6:3:2 B. 1:1:1 C. 9:3:1 D. 3:2:1
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】已知由短周期常见元素形成的纯净物A、B、C、D转化关系如图1琐事,物质A与物质B之间的反应不再溶液中进行. 
(1)若A为金属单质,C是淡黄色固体,D是一元强碱. ①物质B是(填化学式).
②化合物C的电子式为;化合物D中所含化学键的类型是 .
③在常温下,向pH=a的醋酸溶液中加入等体积pH=b的D溶液,且a+b=14,则充分反应后,所得溶液中各种离子的浓度由大到小的顺序是: .
(2)若A为非金属单质,C是有色气体,D是一元强酸. ①B为(填化学式).
②化合物C与H2O反应化学方程式 , 氧化剂与还原剂的质量比为 .
(3)某同学用图2装置完成有关探究实验. Ⅰ试管中发生反应的离子方程式为 .
Ⅱ试管中观察到的实验现象时,说明NO2能溶于浓硫酸中,浓硫酸不能干燥NO2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁溶液与氢氧化铁胶体具有的共同性质是
A.分散质颗粒直径都在l~100nm 之间 B.能透过半透膜
C.加入浓氢氧化钠溶液都产生红褐色沉淀 D.颜色都呈红褐色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置.实验时,先断开K2 , 闭合K1 , 两极均有气泡产生;一段时间后,断开K1 , 闭合K2 , 发现电流表指针偏转,下列有关描述正确的是( ) 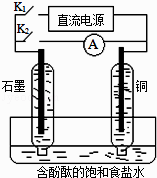
A.断开K2 , 闭合K1时,总反应的离子方程式为:2H++2Cl﹣ ![]() Cl2↑+H2↑
Cl2↑+H2↑
B.断开K2 , 闭合K1时,石墨电极附近溶液变红
C.断开K1 , 闭合K2时,铜电极上的电极反应为:Cl2+2e﹣=2Cl﹣
D.断开K1 , 闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如表所列物质不能按如图关系(“→”表示一步完成)相互转化的是( )
选项 | A | B | C | D |
a | Na | Al | Fe | Cu |
b | NaOH | Al2O3 | FeCl3 | CuSO4 |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校研究性学习小组用一些大部分已经锈蚀(成分为 Fe2O3)的废铁屑制备绿矾(FeSO4·7H2O),实验操作过程如下:

已知:杂质不溶于稀硫酸。
请回答下列问题:
(1)步骤①中,稀硫酸与 Fe2O3反应的离子方程式为 ______,废铁屑用硫酸处理后,还含有不溶性杂质,为获取澄清的A溶液,需进行的操作名称是 _________。
(2)步骤②中溶液A与铁粉反应的离子方程式为________________。
(3)检验溶液 B 中是否还存在杂质金属阳离子的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“吃尽百味还点盐,穿尽绫罗不如棉”。食盐不仅是调味品,更在医药、化工等领域有广泛应用。下列有关叙述中正确的是
A. 食盐熔化时因离子键遭破坏故属化学变化 B. 电解饱和食盐水可制备金属钠
C. 生理盐水的浓度越接近饱和药效越好 D. 加碘食盐中的碘以 IO3- 形成存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+2H2(g)CH3OH(g)△H=﹣a kJmol﹣1 . ①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4molL﹣1、c(H2)=0.4molL﹣1、c(CH3OH)=0.8molL﹣1 , 则此时v正v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15min,用H2表示的平均反应速率为 , 达到平衡时CO的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
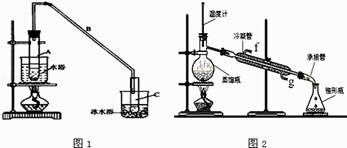
【题目】某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯 已知: 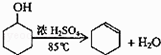
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品. ①A中碎瓷片的作用是 , 导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品 ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2所示装置蒸馏,冷却水从口进入,目的是 .
③收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 . a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com