
【题目】化合物N(![]() )可以增强牙膏、口香糖等制品的香气,其中间体L的合成路线如下:
)可以增强牙膏、口香糖等制品的香气,其中间体L的合成路线如下:

已知:R1、R2、R3、R4表示原子或原子团



请回答:
(1)A的官能团名称是______。
(2)B不能发生银镜反应,A→B的化学方程式是______。
(3)C的结构简式是______。
(4)D→F的反应类型是______,F→G的化学方程式是______。
(5)J的结构简式是______。
(6)K含有六原子环结构,K→L的化学方程式是______。
(7)G和L经过3步反应合成N,路线如下:
![]()
结合中间体L的合成路线,写出下列物质的结构简式:
中间产物1:______,中间产物2:______。
【答案】 羟基 ![]()
![]() 取代反应(或酯化反应)
取代反应(或酯化反应) ![]()
![]()
![]()

![]()
【解析】(1)根据A的分子式可知,该物质属于饱和一元醇或醚,根据该物质能够发生催化氧化反应,所以该有机物为一元醇,含有官能团为羟基;正确答案:羟基。
(2)B不能发生银镜反应,B为丙酮,A为2-丙醇,该醇发生催化氧化的化学方程式是![]() ;正确答案:
;正确答案:![]() 。
。
(3)根据信息I可知,丙酮与甲醛在碱性环境下发生反应生成有机物C,结构简式是![]() ;正确答案:
;正确答案:![]() 。
。
(4)根据D的分子式可知,为饱和一元醇,D为乙醇,结合有机物F的分子式,可知有机物E为乙酸,乙酸和乙醇在浓硫酸作用下发生酯化反应,D→F的反应类型是取代反应(或酯化反应);2个乙酸乙酯分子在乙醇钠的作用下发生反应生成![]() ;F→G的化学方程式是
;F→G的化学方程式是![]() ;正确答案:取代反应(或酯化反应) ;
;正确答案:取代反应(或酯化反应) ;![]() 。
。
(5)根据信息III可知,有机物 在酸性条件下发生反应生成有机物J,结合J的分子式,其结构简式是
在酸性条件下发生反应生成有机物J,结合J的分子式,其结构简式是![]() ;正确答案:
;正确答案:![]() 。
。
(6)![]() 在碱性环境下发生反应生成六原子环结构K,其结构简式为:
在碱性环境下发生反应生成六原子环结构K,其结构简式为:![]() ,该有机物与甲醛反应的化学方程式是
,该有机物与甲醛反应的化学方程式是![]() ;正确答案:
;正确答案:![]() 。
。
(7)有机物L为![]() ,有机物G为
,有机物G为![]() ,二者发生加成反应生成中间产物1:
,二者发生加成反应生成中间产物1: ;根据信息III可知,该有机物在酸性条件下反应生成
;根据信息III可知,该有机物在酸性条件下反应生成![]() ;正确答案:
;正确答案:  ;
; ![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】C、Ti的单质及其化合物在现代社会有广泛用途。
(1)基态钛原子的电子排布式为________。
(2)CS2分子中含有σ键和π键之比为______;NO2+与CO2是等电子体,NO2+的电子式为___,键角为_______。
(3)CH3CHO沸点低于CH3CH2OH的原因是_____;CH3CHO分子中碳原子杂化类型为_____。
(4)钛酸钡(BaTiO3)晶体的某种晶胞如图所示。NA为阿伏加德罗常数值,Ba2+、O2-、Ti4+的半径分别为apm、bpm、cpm。

①与钡离子等距离且最近的氧离子有______个;
②假设晶体中的Ti4+、Ba2+分别与O2-互相接触,则该晶体的密度表达式为______g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用。
I. 用纯净的碳酸钠固体配制500mL 0.40mol/L Na2CO3溶液。
(1)称取Na2CO3固体的质量是______________________g。
(2)配制溶液时,进行如下操作,按照操作顺序,第4步是_________(填字母)。
a. 定容 b. 计算 c. 溶解 d. 摇匀 e. 转移 f. 洗涤 g. 称量
(3)下列说法中,正确的是_____________________(填字母)。
a. 定容时,仰视刻度线,会导致配制的溶液浓度偏小
b. 定容时,如果加水超过刻度线,要用滴管吸出
c. 转移时,溶液倒出容量瓶外,要重新配制溶液
d. 摇匀后,液面低于刻度线,要再加水至刻度线
II. 某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:

(1)工业生产纯碱的第一步是除去饱和食盐水的中SO42―、Ca2+离子,依次加入的试剂及其用量是 ______________、 _______________、 (过滤)、 _______________。
(2)已知:几种盐的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
①写出装置I中反应的化学方程式________________________________________。
②写出装置II中发生反应的化学方程式________________________________。
(3)该流程中可循环利用的物质是__________________。
(4)制出的纯碱中只含有杂质NaCl。
①检验用该纯碱配制的溶液中含有Cl―的方法是_________________________。
②测定该纯碱的纯度,下列方案中可行的是__________(填字母)。
a. 向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b. 向m克纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c. 向m克纯碱样品中加入足量AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中都属于弱电解质的一组是
A. NH3、SO2、H2O、HI
B. HF、H2O、NH3·H2O、H2SO3
C. BaSO4、Cl2、HClO、H2S
D. NaHSO3、H2O、CO2、H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:
![]()
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3 | V2O74 | VO43 |
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是______。
(2)酸浸: ① Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是______。
② 酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%,根据如图推测,酸浸时不选择更高酸度的原因是______。

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:
![]()
① 浸出液中加入石灰乳的作用是______。
② 已知CaCO3的溶解度小于Ca3(VO4)2。向Ca3(VO4)2沉淀中加入(NH4)2CO3溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:______。
③ 向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5。当pH>8时,NH4VO3的产量明显降低,原因是______。
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2+ + 2H+ + Fe2+ == VO2+ + Fe3+ + H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知 MnO4被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是______。(V2O5的摩尔质量:182 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车净化的主要原理为2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) △H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是
2CO2(g)+N2(g) △H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是
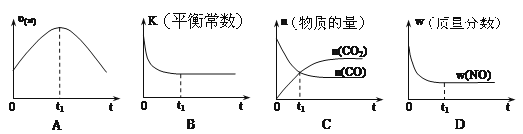
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)滤渣a中除含泥沙外,一定含有____,分离溶液a和滤渣a的操作需要的玻璃仪器为__________________。
(2)溶液a中含铝元素的溶质与过量试剂A反应的离子方程式为_______________,溶液a与过量试剂A反应生成滤渣b的离子方程式为__________________。
(3)溶液b与过量试剂B反应生成滤渣c的离子方程式为_______________________。
(4)加热滤渣c得到氧化铝的操作需要使用的仪器除了酒精灯、三角架、泥三角,还有________(填主要仪器名称),实验室里还常往NaAlO2溶液中通入过量的_______来制取A1(OH)3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示构成细胞的元素及化合物,其中工、ll、Ⅲ是生物大分子,x、y、 z代表不同的小分子。请回答下列问题:

(1)图中Ⅰ在动物细胞中是______,其基本组成单位x是______
(2)若II是染色体的主要成分,则y是______
(3)图中x,y,z共有的化学元素是_。
(4)在生物体中的z,其结构通式为______;请列举出Ⅲ的两个功能: ______、______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com