
【题目】下列各组物质中都属于弱电解质的一组是
A. NH3、SO2、H2O、HI
B. HF、H2O、NH3·H2O、H2SO3
C. BaSO4、Cl2、HClO、H2S
D. NaHSO3、H2O、CO2、H2CO3
科目:高中化学 来源: 题型:
【题目】下列物质空间构型和中心原子杂化类型都正确的是
A. SO3 平面四边形 sp2 B. H2O V字形 sp
C. BCl3 平面三角形 sp3 D. SO32- 三角锥形 sp3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。己知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0 kJ·mol-1 和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是______________kJ。
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______________________________。
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,保持其他条件不变,探究温度对反应的影响,实验结果如下图所示(T1、T2均大于300℃)。下列说法正确的是________________(填序号)
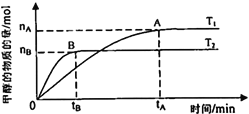
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH) =![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(4)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______________。
Ⅱ.将废水中的有害物质转变为无毒物质、难溶物质及易除去的物质,是废水处理中的重要方法。
(5)含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。其中电解处理法如图:用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入一定量的NaCl,一定条件下电解,阳极产生ClO-的将CN-氧化为无害物质而除去。铁电极为_____________(填“阴极”或“阳极”),阳极产生的ClO-的电极反应为_______________________,阳极产生的ClO-的将CN-氧化为无害物质而除去的离子方程式为___________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于氧化还原反应的是( )
A. S+O 2 ![]() SO2
SO2
B. Fe(OH)3+3HCl===FeCl3+3H2O
C. 2Mg+CO2![]() 2MgO+C
2MgO+C
D. 4HNO3(浓)![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:a.____________,b.___________,e.__________。
(2)仪器a~e中,使用前必须检查是否漏水的有___________。(填序号)
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在_______处。冷凝水由____口流出(填f或g)。
(4)表示溶液浓度的方法通常有两种;溶液中溶质的质量分数(W)和物质的量浓度 (c),把98%(密度为1.84g/cm3)的浓硫酸稀释成2mol/L的稀硫酸100mL,需要量取浓硫酸_______ mL,若配制时没有冷却到室温就转移、定容,则所配溶液的物质的量浓度________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物N(![]() )可以增强牙膏、口香糖等制品的香气,其中间体L的合成路线如下:
)可以增强牙膏、口香糖等制品的香气,其中间体L的合成路线如下:

已知:R1、R2、R3、R4表示原子或原子团



请回答:
(1)A的官能团名称是______。
(2)B不能发生银镜反应,A→B的化学方程式是______。
(3)C的结构简式是______。
(4)D→F的反应类型是______,F→G的化学方程式是______。
(5)J的结构简式是______。
(6)K含有六原子环结构,K→L的化学方程式是______。
(7)G和L经过3步反应合成N,路线如下:
![]()
结合中间体L的合成路线,写出下列物质的结构简式:
中间产物1:______,中间产物2:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)白炭黑(SiO2·H2O)广泛用于橡胶、涂料、印刷等行业,可用蛇纹石[主要成分为Mg6(Si4O10)(OH)8]来制取,其主要工艺流程如下:

(1)蛇纹石用氧化物形式可表示为____________。
(2)碱浸时,为提高其中硅酸盐的浸取率,除采用合适的液固比和循环浸取外,还可采用的方法有①_____________________;②_____________(任举两种)。
(3)过滤1得到的滤液的主要成分是______________________________。
(4)沉淀时加入氯化钠溶液的作用可能是__________________________。
(5)洗涤时,如何证明产品已洗涤干净?_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A.0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
B.0.1mol/L的硫酸和0.1mol/L的氢氧化钡溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的盐酸和pH=10的氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,还含有少量(Hg2+等)重金属化合物杂质。黄铁矿的主要成分是FeS2,还含有SiO2和Al2O3等杂质。工业上采用同槽硫酸酸溶等工艺制备碳酸锰并回收硫酸铵,其主要流程如下:( 已知: Ksp[Al(OH) 3]=1 3×10-33,Ksp[Fe(OH) 3]=5.3×10-38,金属离子的浓度小于1×10-6视为沉淀完全。)

(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有:
①适当升高温度,②搅拌,③_________________等。
(2)流程“氧化”中加入MnO2与Fe2+发生反应的离子方程式为_________________。
(3)“滤渣2”中主要成分的化学式为_________________。
(4)流程“除重金属”时使用(NH4)2S而不使用Na2S的原因是_________________。
(5)流程“50℃碳化”得到碳酸锰,该反应的化学方程式为_________________。
(6)生成的碳酸锰产品需经充分洗涤,检验产品完全洗净的方法是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com