
【题目】(12分)白炭黑(SiO2·H2O)广泛用于橡胶、涂料、印刷等行业,可用蛇纹石[主要成分为Mg6(Si4O10)(OH)8]来制取,其主要工艺流程如下:

(1)蛇纹石用氧化物形式可表示为____________。
(2)碱浸时,为提高其中硅酸盐的浸取率,除采用合适的液固比和循环浸取外,还可采用的方法有①_____________________;②_____________(任举两种)。
(3)过滤1得到的滤液的主要成分是______________________________。
(4)沉淀时加入氯化钠溶液的作用可能是__________________________。
(5)洗涤时,如何证明产品已洗涤干净?_______________________________。
【答案】 6MgO·4SiO2·4H2O; ①适当提高温度,②适当延长浸取时间, ③采用连续搅拌的形式,④适当提高氢氧化钠溶液的浓度; 硅酸钠; 防止生成硅酸胶体; 取少量最后一次洗涤液,滴加1~2滴硝酸银溶液,若没有白色沉淀生成,证明已经洗涤干净。
【解析】(1)硅酸盐由盐的书写形式改写为氧化物的形式,改写的一般方法为:碱性氧化物、两性氧化物、酸性氧化物、水,蛇纹石[主要成分为Mg6(Si4O10)(OH)8]写成氧化物的形式:6MgO·4SiO2·4H2O,正确答案:6MgO·4SiO2·4H2O;
(2)碱浸时,为提高其中硅酸盐的浸取率,可以适当提高温度,加快反应速率,提高浸取率;可以适当延长浸取时间,提高浸取率;可以采用连续搅拌的形式,增大接触面积,加快反应速率,提高浸取率;适当提高氢氧化钠溶液的浓度,加快反应速率,提高浸取率,所以正确答案:①适当提高温度,②适当延长浸取时间,③采用连续搅拌的形式,④适当提高氢氧化钠溶液的浓度;
(3)蛇纹石的主要成分为:6MgO·4SiO2·4H2O,能够与氢氧化钠溶液反应的是SiO2,生成Na2SiO3,所以过滤1得到的滤液的主要成分是硅酸钠,还含有少量的没有反应的氢氧化钠,正确答案:硅酸钠;
(4)硅酸钠和盐酸反应生成硅酸和氯化钠,加入氯化钠的作用是防止生成硅酸胶体,正确答案为:防止生成硅酸胶体;
(5)硅酸钠和盐酸反应生成硅酸和氯化钠,可以检验是否存在氯离子来检验是否洗涤干净,具体方法是:取少量最后一次洗涤液,滴加1~2滴硝酸银溶液,若没有白色沉淀生成,证明已经洗涤干净,正确答案为:取少量最后一次洗涤液,滴加1~2滴硝酸银溶液,若没有白色沉淀生成,证明已经洗涤干净。
(


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式的书写,正确的是
A. NH3·H2O==NH4+ + OH― B. H2SO4==2H+ + SO42―
C. CuCl2== Cu2+ + Cl― D. NaHCO3==Na+ + H+ + CO32―
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于pH=3的CH3COOH溶液的叙述正确的是
A. 溶液中H2O电离出的c(OH)=1.0×103 mol·L1
B. 加入少量CH3COONa固体后,溶液pH升高
C. 加0.1 mol·L1 CH3COONa溶液使pH>7,则c(CH3COO)=c(Na+)
D. 与等体积pH=11的NaOH溶液混合,所得溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中都属于弱电解质的一组是
A. NH3、SO2、H2O、HI
B. HF、H2O、NH3·H2O、H2SO3
C. BaSO4、Cl2、HClO、H2S
D. NaHSO3、H2O、CO2、H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中混有的杂质,选择试剂及操作都正确的一项是( )
选项 | 物质 | 杂质 | 选择试剂 | 实验操作 |
A | Al2O3 | SiO2 | NaOH溶液 | 过滤 |
B | FeCl2 | FeCl3 | Fe粉 | 过滤 |
C | CO2 | SO2 | 澄清石灰水 | 洗气 |
D | I2 | NaCl | 酒精 | 萃取、分液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车净化的主要原理为2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) △H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是
2CO2(g)+N2(g) △H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是
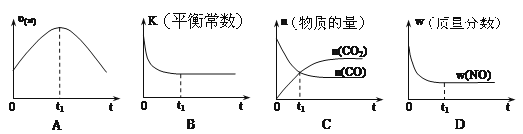
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中通NH3 ⑤向水中加入明矾晶体 ⑥向水中加入NaHCO3固体 ⑦向水中加NaHSO4固体
A. ①③⑥⑦ B. ①③⑥ C. ⑤⑦ D. ⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的利用是国际社会普遍关注的问题。
(1)CO2的电子式是______。
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
![]()
获取乙二醇的反应历程可分为如下2步:
Ⅰ.
Ⅱ.EC加氢生成乙二醇与甲醇
![]()
① 步骤Ⅱ的热化学方程式是______。
② 研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
反应温度/ ℃ | EC转化率/ % | 产率/ % | |
乙二醇 | 甲醇 | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
由上表可知,温度越高,EC的转化率越高,原因是______。温度升高到220 ℃时,乙二醇的产率反而降低,原因是______。
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极a接电源的______极(填“正”或“负”),生成甲醇的电极反应式是______。

(4)CO2较稳定、能量低。为实现CO2的化学利用,下列研究方向合理的是______(填序号)。
a.选择高能量的反应物和CO2反应获得低能量的生成物
b.利用电能、光能或热能活化CO2分子
c.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是( )
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是( )
容器 编号 | 物质的起始浓度 (mol·L-1) | 物质的平衡浓度 (mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 容器Ⅰ中发生反应的平衡常数为0.8 B. 容器Ⅱ中发生反应的起始阶段有v正>v逆
C. 达到平衡时,容器Ⅲ中![]() >1 D. 达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17
>1 D. 达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com