
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
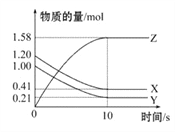
A. 反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B. 10 s后,该反应停止进行
C. 反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
D. 0~10 s的时间内的平均反应速率:v(X)=v(Y)=0.0395 mol·L-1·s-1
【答案】D
【解析】A.10s内,用Z表示的反应速率为v(Z)=1.58mol/(2L·10s)=0.079moL/(Ls),A错误;B.由图可知,l0s后,该反应到达平衡状态,化学平衡状态是动态平衡,v(正)=v(逆)≠0,B错误;C.由图象可以看出,随反应进行X、Y的物质的量减小,Z的物质的量增大,所以X、Y是反应物,Z是生产物,l0s后X、Y、Z的物质的量为定值,不为0,反应是可逆反应,且△n(X):△n(Y):△n(Z)=(1.20-0.41)mol:(1.00-0.21)mol:1.58mol=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,故反应化学方程式为X(g)+Y(g)2Z(g),C错误;D.0~10 s的时间内的平均反应速率:v(X)=v(Y)= 0.79mol/(2L·10s)=0.0395 mol·L-1·s-1,D正确;答案选D。


科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )

A. 简单离子的半径:X<Z<M
B. 最高价氧化物对应水化物的酸性:R<N
C. Y、R两种元素的气态氢化物稳定性:Y>R
D. 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应原理中,不符合工业冶炼金属实际情况的是
A.2HgO![]() 2Hg+O2↑ B.4Al+3MnO2
2Hg+O2↑ B.4Al+3MnO2![]() 2Al2O3+3Mn
2Al2O3+3Mn
C.2MgO![]() 2Mg+O2↑ D.4CO+Fe3O4
2Mg+O2↑ D.4CO+Fe3O4![]() 3Fe+4CO2
3Fe+4CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
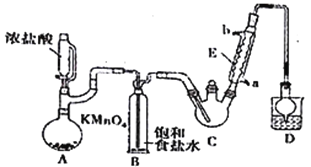
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应: C2H5OH+HCl→C2H5Cl+H2O;
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器A中发生反应的化学方程式为_________________________________。
(2)装置B的作用是_________________。该实验在装置中有一处缺陷,即缺少氯气的干燥裝置,缺少该装置可能导致装置C 中副产物______________(填化学式)的量增加;冷凝管的进水口是________(填“a”或“b”);
(3)装置中球形冷凝管的作用是______________________,写出D中所有可能发生的无机反应的离子方程式___________________________________。
(4)反应结束后,从C中的混合物中分离出CCl3COOH的方法是_________________________。
(5)测定产品纯度:称取产品0.50g配成待测溶液,加0.1000 molL-1碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000 molL-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为_____________;(计算结果保留两位有效数字)滴定的反应原理:CCl3CHO+OH-==CHCl3span>+HCOO- HCOO-+I2== H++2I-+CO2↑ I2+2S2O32-==2I-+ S4O62-
(6)为证明三氯乙酸的酸性比乙酸强。某学习小组的同学设计了以下三种方案,你认为能够达到实验目的的是___________。
a.分别测定0.1mol·L-1两种酸溶液的pH,三氯乙酸的pH 较小
b.用仪器测量浓度均为0.1mol·L-1 的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH 较大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年巴黎气候变化大会规定:本世纪实现温室气体净零排放.下列物质燃烧时能实现二氧化碳零排放的是( )
A.天然气
B.氢气
C.水煤气
D.煤炭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.0.1 molL﹣1醋酸溶液中含有醋酸分子的数目为0.1NA
B.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.2 NA
C.常温下,20 L pH=12的Na2CO3溶液中含有OH﹣数目为0.2 NA
D.某密闭容器盛有0.1 mol N2和0.3 mol H2 , 在一定条件下充分反应,转移电子数目为0.6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在炼锌厂和炼钢厂废弃的含锌烟道灰中,含有30%~50%的氧化锌,另含少量Fe2O3、CuO、SiO2、MnO等物质,可用该烟道灰为原料生产草酸锌晶体(ZnC2O4·2H2O)。
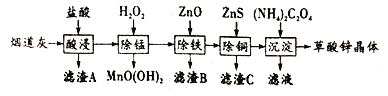
请回答下列问题:
(1)为了提高漫出速率,除将烟道灰处理得更细外,还可采取的措施有______ (写出一条)。
(2)证明除铁工序中Fe3+已经沉淀完全的实验步骤及现象是__________.
(3)上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是__________.
(4)己知: 常温下,Ksp[Fe(OH)3]=8.0×10-38.当加入ZnO控制反应液pH=5.0时,溶液中c(Fe3+)=_________.
(5)草酸能使酸性高锰酸钾溶液褪色,试写出相关反应的离子方程式:___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )。
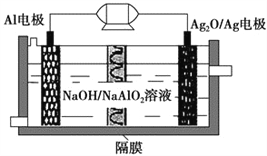
A. 工作时正极发生还原反应,且正极质量逐渐减小
B. 当电极上生成1.08 g Ag时,电路中转移的电子为0.1 mol
C. Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O
D. 工作时电解液中的Na+移向Ag2O/Ag电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com