
【题目】工业上可用铁盐溶液溶解黄铁矿(主要成分为FeS2),发生如下过程。下列说法错误的是
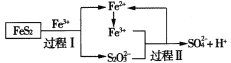
A.过程I每溶解120 g FeS2,理论上消耗6 mol Fe3+
B.过程Ⅱ每生成1 mol SO42-转移8 mol e-
C.总反应为FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
D.反应过程中鼓入大量的空气有利于反应的进行
【答案】B
【解析】
A. 在过程I中发生反应,使S22-转化为S2O32-,S元素化合价由反应前-1价变为反应后+2,S元素化合价共升高2×3=6价,失去6 mol电子,每溶解120 g即1 mol FeS2,反应转移6 mol电子,根据电子守恒可知需消耗6 mol Fe3+,A正确;
B. 在过程II中Fe3+将S2O32-氧化为SO42-,S元素化合价由反应前+2价变为反应后的+6价,每1 mol S2O32-反应产生2 mol SO42-,元素化合价共升高2×4=8价,则产生1 mol SO42-转移4 mol e-,B错误;
C. 根据示意图可知FeS2与Fe3+及H2O发生反应后最终变为SO42-、Fe2+及H+,根据电子守恒、电荷守恒及原子守恒,可得反应总方程式为:FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+,C正确;
D. 反应过程中鼓入大量的空气,可以将其中S元素氧化为SO2,将+2价Fe氧化为Fe3+,在溶液中Fe3+进一步把SO2氧化为SO42-,可见鼓入足量空气将促使反应正向进行,有利于反应的进行,D正确;
故合理选项是B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于化学反应的说法中正确的是
A. 同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D. 相同温度下,H2(g)+CO2(g)![]() CO(g)+H2O(g)中,密闭容器中两种反应物浓度为0.020 mol·L-1的反应速率大于两种反应物浓度为0.010 mol·L-1的反应速率
CO(g)+H2O(g)中,密闭容器中两种反应物浓度为0.020 mol·L-1的反应速率大于两种反应物浓度为0.010 mol·L-1的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 铝粉投入NaOH溶液中:2Al+2OH-===2AlO2-+H2↑
B. Na与CuSO4溶液反应:Cu2++2Na===2Na++Cu
C. 向AlCl3溶液中加入足量的氨水:Al3++3OH-===Al(OH)3↓
D. Ba(OH)2溶液与稀硫酸反应:Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56gCu和200mL某浓度的浓HNO3混合,随着反应的进行生成气体的颜色逐渐变浅,当Cu反应完全时,共收集到气体1.12L(标准状况)。
下列关于该反应的分析错误的是( )
A.该反应生成的NO2与NO的体积比为7 : 3
B.该反应转移电子数为0.04NA
C.该反应消耗HNO3的物质的量为0.13mol
D.反应结束后所得溶液中(忽略反应前后溶液体积的变化)c(NO3-) = 0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下3个热化学方程式:H2(g)+![]() O2(g)= H2O(g) △H=a kJ/mol,H2(g)+
O2(g)= H2O(g) △H=a kJ/mol,H2(g)+ ![]() O2(g)= H2O(l) △H=b kJ/mol,2H2(g) +
O2(g)= H2O(l) △H=b kJ/mol,2H2(g) + ![]() O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
A.它们都是吸热反应B.a、b、c均为正值C.a=bD.c=2b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 强酸跟强碱的反应热一定是中和热
B. 1molC完全燃烧放热383.3kJ,其热化学方程为:C+O2=CO2ΔH=-383.3kJ·mol-1
C. 在稀溶液中,酸与碱发生中和反应生成1 mol H2O时的反应热叫做中和热
D. 表示中和热的离子方程式为:H+(aq)+OH-(aq)![]() H2O(l);ΔH=57.3KJ·mol-1
H2O(l);ΔH=57.3KJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,从A处通入新制备的Cl2,关闭B阀时,C处的红色布条看不到明显现象;当打开B阀后,C处红色布条逐渐褪色。D瓶中装的是( )

①浓硫酸 ②NaOH溶液 ③H2O ④饱和NaCl溶液
A. ①③ B. ②④ C. ①② D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
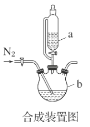
【题目】甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组模拟其合成方法如图:
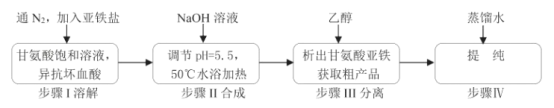
已知:

请回答:
(1)合成装置中仪器b的名称是___。
(2)合成过程中,本实验为了防止Fe2+被氧化,采取的措施是___。
(3)写出水浴加热过程中生成甘氨酸亚铁络合物的离子方程式___。
(4)下列说法正确的是___。
A.滴入液体前,应先打开滴液漏斗a的上口玻璃塞
B.根据题中所给信息,亚铁盐应选用FeSO4·7H2O
C.步骤Ⅲ中的分离方法是过滤
D.步骤IV,提纯操作中的干燥过程最好选用真空干燥
(5)合成过程需控制pH=5.5,试说明理由___。
(6)步骤Ⅲ加入无水乙醇的目的是___。
(7)若甘氨酸的投料量为300kg,得到纯品344.8kg,则产品的产率为___ %(保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com