
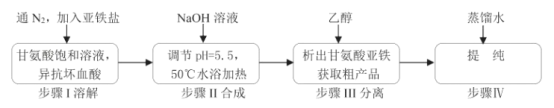
【题目】甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组模拟其合成方法如图:
已知:

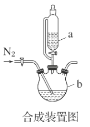
请回答:
(1)合成装置中仪器b的名称是___。
(2)合成过程中,本实验为了防止Fe2+被氧化,采取的措施是___。
(3)写出水浴加热过程中生成甘氨酸亚铁络合物的离子方程式___。
(4)下列说法正确的是___。
A.滴入液体前,应先打开滴液漏斗a的上口玻璃塞
B.根据题中所给信息,亚铁盐应选用FeSO4·7H2O
C.步骤Ⅲ中的分离方法是过滤
D.步骤IV,提纯操作中的干燥过程最好选用真空干燥
(5)合成过程需控制pH=5.5,试说明理由___。
(6)步骤Ⅲ加入无水乙醇的目的是___。
(7)若甘氨酸的投料量为300kg,得到纯品344.8kg,则产品的产率为___ %(保留一位小数)。
【答案】三颈烧瓶 通入氮气,加入异抗坏血酸 2H2NCH2COOH+Fe2+=[(H2NCH2COO)2Fe]+2H+ CD pH过低,H+会与H2NCH2COOH中的氨基反应,使产率下降,pH过高会生成氢氧化亚铁沉淀 降低甘氨酸亚铁在水中的溶解度,促使其结晶析出;除去杂质,提高产率和纯度 84.5
【解析】
(1)根据图示中装置的结构分析解答;
(2)亚铁离子易被氧气氧化,结合过程中通入的氮气和异抗坏血酸的性质分析解答;
(3)甘氨酸亚铁易溶于水,水浴加热甘氨酸饱和溶液和硫酸亚铁的混合物反应生成甘氨酸亚铁络合物,据此书写反应的离子方程式;
(4)根据装置图中中使用的是恒压滴液漏斗的结构判断A;根据FeSO4·7H2O易溶于水,难溶于乙醇,FeCl2·4H2O易溶于乙醇,结合合成过程分析判断B;步骤Ⅲ为分离液体和固体的操作据此判断C;甘氨酸亚铁容易被氧化,据此判断D;
(5)pH过低,H+会与H2NCH2COOH中的氨基反应,pH过高会生成氢氧化亚铁沉淀,据此分析解答;
(6)根据甘氨酸亚铁易溶于水,难溶于乙醇,结合合成过程分析解答;
(7)根据氮原子守恒,结合产率=![]() ×100%计算。
×100%计算。
(1)根据图示,合成装置中仪器b为三颈烧瓶,故答案为:三颈烧瓶;
(2)甘氨酸饱和溶液中通入氮气,气流通过溶液,能起搅拌溶液的作用,搅拌可以加快化学反应速率,同时除去溶液中溶解的氧气,加入异抗坏血酸,异抗坏血酸介于弱酸性和强还原性,都能防止亚铁离子被氧气氧化,故答案为:通入氮气,加入异抗坏血酸;
(3)甘氨酸亚铁络合物易溶于水,水浴加热甘氨酸饱和溶液和硫酸亚铁的混合物反应生成甘氨酸亚铁络合物,反应的离子方程式为:2NH2CH2COOH+Fe2+=(NH2CH2COO)2Fe+2H+,加入氢氧化钠使反应能够完全进行,故答案为: 2NH2CH2COOH+Fe2+=(NH2CH2COO)2Fe+2H+;
(4)A.装置中使用的是恒压滴液漏斗,滴入液体前,无需打开滴液漏斗a的上口玻璃塞,故A错误;B. FeSO4·7H2O易溶于水,难溶于乙醇,在加入乙醇析出甘氨酸亚铁时会混入杂质,而FeCl2·4H2O易溶于乙醇,不会引入杂质,因此亚铁盐应选用FeCl2·4H2O,故B错误;C. 加入乙醇析出甘氨酸亚铁,步骤Ⅲ为分离液体和固体的操作,分离方法是过滤,故C正确;D.步骤IV中,用蒸馏水洗涤除去乙醇,得到纯净的甘氨酸亚铁,甘氨酸亚铁容易被氧化,因此干燥过程最好选用真空干燥,故D正确;故答案为:CD;
(5)pH过低,H+会与H2NCH2COOH中的氨基反应,使产率下降,pH过高会生成氢氧化亚铁沉淀,因此合成过程需控制pH=5.5,故答案为:pH过低,H+会与H2NCH2COOH中的氨基反应,使产率下降,pH过高会生成氢氧化亚铁沉淀;
(6)甘氨酸亚铁易溶于水,难溶于乙醇,步骤Ⅲ加入无水乙醇,降低甘氨酸亚铁在水中的溶解度,促使其结晶析出;同时除去杂质,提高甘氨酸亚铁的产率和纯度,故答案为:降低甘氨酸亚铁在水中的溶解度,促使其结晶析出;除去杂质,提高产率和纯度;
(7)甘氨酸的投料量为300kg,甘氨酸的物质的量n=![]() =4×103mol,生成n[(NH2CH2COO)2Fe]=2×103mol,产率为=
=4×103mol,生成n[(NH2CH2COO)2Fe]=2×103mol,产率为=![]() ×100%=84.5%,故答案为:84.5。
×100%=84.5%,故答案为:84.5。


科目:高中化学 来源: 题型:
【题目】工业上可用铁盐溶液溶解黄铁矿(主要成分为FeS2),发生如下过程。下列说法错误的是
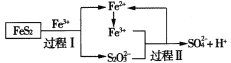
A.过程I每溶解120 g FeS2,理论上消耗6 mol Fe3+
B.过程Ⅱ每生成1 mol SO42-转移8 mol e-
C.总反应为FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
D.反应过程中鼓入大量的空气有利于反应的进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、NO、NO2都是常见重要的无机物,是工农业生产、环境保护、生命科学等方面的研究热点。
(1)写出氨在催化剂条件下与氧气反应生成NO的化学方程式_____。
(2)氮氧化物不仅能形成酸雨,还会对环境产生的危害是形成_____。
(3)实验室可用Cu与浓硝酸制取少量NO2,该反应的离子方程式是_____。
(4)为了消除NO对环境的污染,根据氧化还原反应原理,可选用NH3使NO转化为两种无毒气体(其中之一是水蒸气),该反应需要催化剂参加,其化学方程式为_____。
(5)一定质量的Cu与适量浓硝酸恰好完全反应,生成标准状况下NO2和NO气体均为2240mL。向反应后的溶液中加入NaOH溶液使Cu2+刚好完全沉淀,则生成Cu(OH)2沉淀的质量为_____克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中不正确的是

A. 该生产工艺中Br2被循环利用
B. 在电解过程中,电解槽阴极附近溶液的pH变大
C. 原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+
D. 该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热△H=﹣890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ/mol
B. 一定条件下,将0.5 molN2和1.5molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ/mol
2NH3(g)△H=﹣38.6kJ/mol
C. 已知2C(s)+2O2(g) ═2CO2(g);△H1;2C(s)+O2(g)=2CO(g) △H2 则△H1>△H2
D. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”已成为各地的标牌。
(1)硫酸工业排出的尾气(主要含SO2)有多种处理方式
①下列物质中可以吸收硫酸工业尾气的是___
a.饱和Na2SO3溶液 b.饱和NaCl溶液 c.稀H2SO4 d.浓氨水
②硫酸工业排出的尾气也可用软锰矿浆(主要成分为MnO2)吸收,生成MnSO4,写出反应的化学方程式___。
(2)治理汽车尾气中NO和CO的方法之一是在汽车的排气管上装一个催化转化装置,使NO和CO在催化剂作用下转化为无毒物质。写出该反应的化学方程式:___。
(3)用NaOH溶液亦可以吸收废气中的氮氧化物,化学方程式如下NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O
①上述两反应中分别消耗等量的NO2时,转移电子的物质的量之比为___。
②标准状况下5.6L混合气体(只有NO、NO2)被0.5molL﹣1NaOH溶液完全吸收,至少需要NaOH溶液的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3+5O2=4NO+6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mo1,则此反应的平均速率Vx为( )
A. VO2=0.01mo1L-1s-1B. VNO=0.008mo1L-1s-1
C. VH2O=0.002mo1L-1s-1D. VNH3=0.002mo1L-1s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2(g) + O2(g)![]() 2SO3(g) △H<0
2SO3(g) △H<0
①增加O2的浓度,平衡___移动,SO2的浓度___,SO3的物质的量___。
②增大压强,平衡___移动, SO2的浓度____,SO3的浓度___。
③升高温度,平衡____移动,SO2的浓度___,SO3的浓度____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3H2+N2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
A. v正(N2)=v正(H2)B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)D. v正(N2)=3v逆(H2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com