
【题目】对于反应2SO2(g) + O2(g)![]() 2SO3(g) △H<0
2SO3(g) △H<0
①增加O2的浓度,平衡___移动,SO2的浓度___,SO3的物质的量___。
②增大压强,平衡___移动, SO2的浓度____,SO3的浓度___。
③升高温度,平衡____移动,SO2的浓度___,SO3的浓度____。
【答案】向右(正向) 减小 增大 向右(正向) 减小 增大 向左(逆向) 增大 减小
【解析】
对于反应2SO2(g) + O2(g)![]() 2SO3(g) △H<0
2SO3(g) △H<0
①增加反应物O2的浓度,平衡正向移动,反应物SO2的浓度减小,生成物SO3的物质的量增大。答案:向右(正向);减小;增大;
②此反应为化学反应方程式计量数减小的反应,所以增大压强,平衡正向移动,SO2的浓度减小,SO3的浓度增大。答案:向右(正向);减小 ;增大;
③由于反应2SO2(g)+ O2(g)![]() 2SO3(g) △H<0为放热反应,升高温度,平衡逆向移动,SO2的浓度增大,SO3的浓度减小,所以本题答案:向左(逆向);增大 ;减小。
2SO3(g) △H<0为放热反应,升高温度,平衡逆向移动,SO2的浓度增大,SO3的浓度减小,所以本题答案:向左(逆向);增大 ;减小。


科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
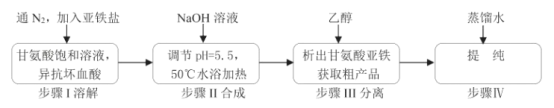
【题目】甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组模拟其合成方法如图:
已知:

请回答:
(1)合成装置中仪器b的名称是___。
(2)合成过程中,本实验为了防止Fe2+被氧化,采取的措施是___。
(3)写出水浴加热过程中生成甘氨酸亚铁络合物的离子方程式___。
(4)下列说法正确的是___。
A.滴入液体前,应先打开滴液漏斗a的上口玻璃塞
B.根据题中所给信息,亚铁盐应选用FeSO4·7H2O
C.步骤Ⅲ中的分离方法是过滤
D.步骤IV,提纯操作中的干燥过程最好选用真空干燥
(5)合成过程需控制pH=5.5,试说明理由___。
(6)步骤Ⅲ加入无水乙醇的目的是___。
(7)若甘氨酸的投料量为300kg,得到纯品344.8kg,则产品的产率为___ %(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
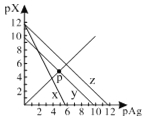
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若反应2NO(g)+O2(g)![]() 2NO2的平衡常数为K1,2NO2(g)
2NO2的平衡常数为K1,2NO2(g)![]() N2O4(g)的平衡常数为K2,则反应2NO(g)+O2(g)
N2O4(g)的平衡常数为K2,则反应2NO(g)+O2(g)![]() N2O4(g)的平衡常数K=___。
N2O4(g)的平衡常数K=___。
(2)25℃、101KPa时,1Kg乙醇充分燃烧后放出的热量为29714kJ,则乙醇的燃烧热△H=__。
(3)反应mA+nB![]() pC在某温度下达到平衡。
pC在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关是___。
②若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向___方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为__态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平。一段时间后能观察到铁钉生锈。下列说法不正确的是( )
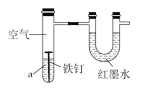
A. 铁钉表面发生的反应为Fe-3e-=Fe3+
B. 若液体a为稀醋酸,则U形管液面右高左低
C. 若液体a为食盐水,则U形管液面左高右低
D. 若液体a为食用油,则铁钉生锈速率较慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的转化关系如图所示(部分反应条件己路去)。A是紫红色的金属单质,B为强酸,E在常温下为无色液体,D、F、G为气体。请回答下列问题:
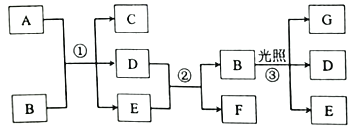
(1)G的化学式为___,实验室中试剂B应保存在___中。
(2)写出反应①的化学方程式:___,反应中B体现的性质为___。
(3)写出反应②的离了方程式:___,实验室中F可用___法收集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组模拟合成氨过程,通过仪器测得正反应速率与时间的图象如下图所示,请回答相关问题:
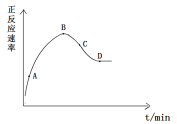
(1)合成氨过程需加入催化剂,催化剂是通过_________来增大反应速率的。
(2)正反应速率呈现出先增大后减小的原因可能是___________。
(3)v正-t图象中A、B、C、D四点属于平衡状态的是___点,你的理由是___。
(4)请在图中画出相应的逆反应速率图象_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出除杂所用试剂及方法(括号里面是杂质)
①溴苯(溴) 试剂__________;方法_____;
②乙烷(乙烯)试剂___;方法____;
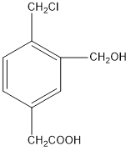
(2)某有机物的结构简式如图所示,若等物质的量的该有机物分别与足量Na、NaOH、NaHCO3恰好反应时,则消耗Na、NaOH、NaHCO3的物质的量之比是__________。
(3)有机物A只含有C、H、O三种元素,常用作有机合成的中间体。 16.8 g该有机物经燃烧生成44.0 gCO2和14.4 gH2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有-O-H键和位于分子端的-C≡C-键,核磁共振氢谱有三个峰,峰面积比为6:1:1。
①A的分子式是______ ; A的结构简式是_______;
②有机物B是A的同分异构体,1 mol B可与1mol Br2加成。该有机物所有碳原子在同一个平面,没有顺反异构现象。B的结构简式是_____;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com