
【题目】下列有关物质的转化关系如图所示(部分反应条件己路去)。A是紫红色的金属单质,B为强酸,E在常温下为无色液体,D、F、G为气体。请回答下列问题:
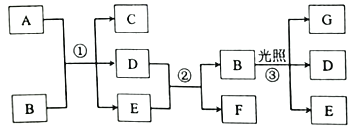
(1)G的化学式为___,实验室中试剂B应保存在___中。
(2)写出反应①的化学方程式:___,反应中B体现的性质为___。
(3)写出反应②的离了方程式:___,实验室中F可用___法收集。
【答案】O2 棕色试剂瓶 Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O 强氧化性、酸性 3NO2+H2O=2H++2NO3-+NO 排水
【解析】
A是紫红色的金属单质,则A为Cu,B为强酸,且与Cu反应生成C、D、E,而E在常温下为无色液体,可知B为硝酸或硫酸,而D能与E反应生成B与F,且D、F为气体, 可推知B为浓硝酸、C为![]() 、D为
、D为![]() 、E为
、E为![]() 、F为NO,硝酸在光照条件下分解生成的气体G为
、F为NO,硝酸在光照条件下分解生成的气体G为![]() 。
。
(1)由分析可知,G的化学式为:O2.B为浓硝酸,实验室中试剂B应保存在:棕色试剂瓶中,故答案为:O2;棕色试剂瓶;
(2)反应①的化学方程式:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,反应中硝酸体现的性质为:强氧化性、酸性,故答案为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;强氧化性、酸性;
(3)反应②的离了方程式:3NO2+H2O═2H++2NO3﹣+NO,实验室中F(NO)可用排水法收集,
故答案为:3NO2+H2O═2H++2NO3﹣+NO;排水。


科目:高中化学 来源: 题型:
【题目】NH3、NO、NO2都是常见重要的无机物,是工农业生产、环境保护、生命科学等方面的研究热点。
(1)写出氨在催化剂条件下与氧气反应生成NO的化学方程式_____。
(2)氮氧化物不仅能形成酸雨,还会对环境产生的危害是形成_____。
(3)实验室可用Cu与浓硝酸制取少量NO2,该反应的离子方程式是_____。
(4)为了消除NO对环境的污染,根据氧化还原反应原理,可选用NH3使NO转化为两种无毒气体(其中之一是水蒸气),该反应需要催化剂参加,其化学方程式为_____。
(5)一定质量的Cu与适量浓硝酸恰好完全反应,生成标准状况下NO2和NO气体均为2240mL。向反应后的溶液中加入NaOH溶液使Cu2+刚好完全沉淀,则生成Cu(OH)2沉淀的质量为_____克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3+5O2=4NO+6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mo1,则此反应的平均速率Vx为( )
A. VO2=0.01mo1L-1s-1B. VNO=0.008mo1L-1s-1
C. VH2O=0.002mo1L-1s-1D. VNH3=0.002mo1L-1s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2(g) + O2(g)![]() 2SO3(g) △H<0
2SO3(g) △H<0
①增加O2的浓度,平衡___移动,SO2的浓度___,SO3的物质的量___。
②增大压强,平衡___移动, SO2的浓度____,SO3的浓度___。
③升高温度,平衡____移动,SO2的浓度___,SO3的浓度____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电化学的叙述正确的是( )
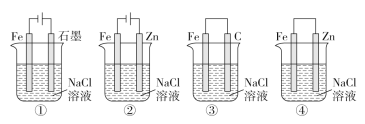
A. 图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红
B. 图②装置中Fe电极参与反应发生腐蚀
C. 图③可以模拟钢铁的吸氧腐蚀,碳棒一极的电极反应式:O2+2H2O+4e-=4OH-
D. 上述4个装置中,图①、②中Fe腐蚀速率较快,图③中Fe腐蚀速率较慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置模拟“侯氏制碱法”,通过制备的NH3和CO2,与饱和食盐水反应先制备NaHCO3。下列说法正确的是( )
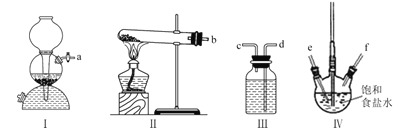
A.实验时装置I产生的气体应先通人到装置IV中
B.装置II中的试剂为浓硫酸
C.导管口的连接顺序为a-e-f-d-c-b
D.实验过程中,装置IV内会出现浑浊现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】荣获2019年诺贝尔化学奖的吉野彰是最早开发具有商业价值的锂离子电池的日本科学家,他设计的可充电电池的工作原理示意图如图所示。该可充电电池的放电反应为LixCn+Li(1-x)CoO2=LiCoO2+nC。NA表示阿伏伽德罗常数的值。下列说法错误的是( )
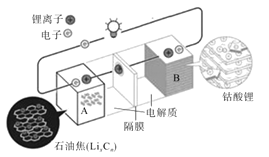
A.该电池用于电动汽车可有效减少光化学烟雾污染
B.充电时,正极反应为LiCoO2-xe-=Li(1-x)CoO2+xLi+
C.放电时,Li+由A极移向B极
D.若初始两电极质量相等,当转移2NA个电子时,两电极质量差为14g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3H2+N2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
A. v正(N2)=v正(H2)B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
①![]()
![]()
②![]()
![]()
③断裂![]() 气体中的化学键需要吸收1076kJ的能量,断裂
气体中的化学键需要吸收1076kJ的能量,断裂![]() 气体中的化学键需要吸收1490kJ的能量。
气体中的化学键需要吸收1490kJ的能量。
请回答:
(1)断裂![]() 中所有化学键需要吸收的能量为________kJ。
中所有化学键需要吸收的能量为________kJ。
(2)T1℃时,向密闭容器中加入一定量的![]() 和C,发生反应①,达到平衡后
和C,发生反应①,达到平衡后![]() 的浓度为
的浓度为![]() ;其他条件不变,缩小容器体积,再次达到平衡时,
;其他条件不变,缩小容器体积,再次达到平衡时,![]() 的浓度为
的浓度为![]() ,则a________b(选填“>”“<”或“=”)。
,则a________b(选填“>”“<”或“=”)。
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的![]() 和CO发生反应②,测得相关数据如表所示:
和CO发生反应②,测得相关数据如表所示:
编号 | 容器 | 起始时物质的量/mol | 平衡时物质的量/mol | 平衡常数(K) | |
|
|
| |||
1 | 恒温 | 0.5 | 1.5 | 0.8 K1 | |
2 | 恒温 | 2 | 3 | M | K2 |
3 | 绝热 | 1 | 1.5 | n | K3 |
①T2℃时,容器1中反应的平衡常数K1=_______。
②容器2中,5min达到平衡,则0~5min以![]() 表示该反应的速率
表示该反应的速率![]() ___________。
___________。
③对于三个容器中的反应,下列说法正确的是(填字母)_________。
A.![]() B.容器1和容器2中
B.容器1和容器2中![]() 的平衡转化率
的平衡转化率![]()
C.![]() D.平衡时气体压强:
D.平衡时气体压强:![]()
(4)一定条件下,向恒压密闭容器中充入0.5mol ![]() 和1.0mol CO,发生反应②,CO和
和1.0mol CO,发生反应②,CO和![]() 的物质的量浓度(c)与时间(t)的关系如图所示:
的物质的量浓度(c)与时间(t)的关系如图所示:

①6min时改变的外界条件为________________。
②若在6min时,恒温将容器体积扩大到10L,请在图中画出6~10min![]() 的物质的量浓度随时间变化的曲线_________。
的物质的量浓度随时间变化的曲线_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com