
����Ŀ����������������Ӧ����㷺�Ľ����������������ܹ�ע����֪��
��![]()
![]()
��![]()
![]()
�۶���![]() �����еĻ�ѧ����Ҫ����1076kJ������������
�����еĻ�ѧ����Ҫ����1076kJ������������![]() �����еĻ�ѧ����Ҫ����1490kJ��������
�����еĻ�ѧ����Ҫ����1490kJ��������
��ش�
(1)����![]() �����л�ѧ����Ҫ���յ�����Ϊ________kJ��
�����л�ѧ����Ҫ���յ�����Ϊ________kJ��
(2)T1��ʱ�����ܱ������м���һ������![]() ��C��������Ӧ�٣��ﵽƽ���
��C��������Ӧ�٣��ﵽƽ���![]() ��Ũ��Ϊ
��Ũ��Ϊ![]() �������������䣬��С����������ٴδﵽƽ��ʱ��
�������������䣬��С����������ٴδﵽƽ��ʱ��![]() ��Ũ��Ϊ
��Ũ��Ϊ![]() ����a________b(ѡ����>����<������=��)��
����a________b(ѡ����>����<������=��)��
(3)��ʼ�¶Ⱦ�ΪT2��ʱ�����ݻ�Ϊ10L�����������ܱ������У��ֱ����һ������![]() ��CO������Ӧ�ڣ����������������ʾ��
��CO������Ӧ�ڣ����������������ʾ��
��� | ���� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | ƽ�ⳣ��(K) | |
|
|
| |||
1 | ���� | 0.5 | 1.5 | 0.8 K1 | |
2 | ���� | 2 | 3 | M | K2 |
3 | ���� | 1 | 1.5 | n | K3 |
��T2��ʱ������1�з�Ӧ��ƽ�ⳣ��K1=_______��
������2�У�5min�ﵽƽ�⣬��0~5min��![]() ��ʾ�÷�Ӧ������
��ʾ�÷�Ӧ������![]() ___________��
___________��
�۶������������еķ�Ӧ������˵����ȷ����(����ĸ)_________��
A.![]() B.����1������2��
B.����1������2��![]() ��ƽ��ת����
��ƽ��ת����![]()
C.![]() D.ƽ��ʱ����ѹǿ��
D.ƽ��ʱ����ѹǿ��![]()
(4)һ�������£����ѹ�ܱ������г���0.5mol ![]() ��1.0mol CO��������Ӧ�ڣ�CO��
��1.0mol CO��������Ӧ�ڣ�CO��![]() �����ʵ���Ũ��(c)��ʱ��(t)�Ĺ�ϵ��ͼ��ʾ��
�����ʵ���Ũ��(c)��ʱ��(t)�Ĺ�ϵ��ͼ��ʾ��

��6minʱ�ı���������Ϊ________________��
������6minʱ�����½������������10L������ͼ�л���6~10min![]() �����ʵ���Ũ����ʱ��仯������_________��
�����ʵ���Ũ����ʱ��仯������_________��
���𰸡�834.5 = 64 0.048molL-1min-10.048molL-1min-1 AD ���� 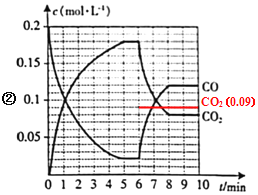
��������
(1)���ݸ�˹���ɣ�![]() ��-
��-![]() �ڵ�C(s)+CO2(g)2CO(g)��H=172.5kJmol-1����H=��Ӧ������ܺ�-����������ܺͣ��裺����1molC(s)�����л�ѧ����Ҫ���յ�����ΪxkJ������172.5=x+1490-1076��2�����x=834.5kJ���ʴ�Ϊ��834.5��
�ڵ�C(s)+CO2(g)2CO(g)��H=172.5kJmol-1����H=��Ӧ������ܺ�-����������ܺͣ��裺����1molC(s)�����л�ѧ����Ҫ���յ�����ΪxkJ������172.5=x+1490-1076��2�����x=834.5kJ���ʴ�Ϊ��834.5��
(2)�����������䣬��С����������ٴδﵽƽ��ʱ����ƽ����ԭƽ��Ϊ��Чƽ�⣬CO2��Ũ��Ϊ���䣬��a=b���ʴ�Ϊ��=��
(3)�ٲ��õ�1�����ݽ��м��㣬ƽ��ʱn(Fe)=0.8mol�����ݷ�Ӧ����ʽFe2O3(s)+3CO(g)2Fe(s)+3CO2(g)��֪�����ɵ�n(CO2)=1.2mol����Ӧ��n(CO)=1.2mol��ʣ���n(CO)=1.5mol-1.2mol=0.3mol�����������Ϊ10L������K=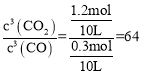 ��
��
�ڸ÷�Ӧ��Ӧǰ������������䣬������1������2Ϊ��Чƽ�⣬ת������ȣ����n(CO)=3mol��0.8=2.4mol�����n(CO2)=3mol��0.8=2.4mol��v(CO2)=![]() =
=![]() =0.048molL-1min-1��
=0.048molL-1min-1��
��A���綼�ں�������������2������3Ϊ��Чƽ�⣬��m=2n��������3�ھ��������£���Ӧ���Ƿ��ȷ�Ӧ���¶����ߣ�ƽ�������ƶ�����m��2n����A��ȷ��
B������1������2Ϊ��Чƽ�⣬CO��ƽ��ת������1=��2����B����
C��K���¶Ⱥ������¶Ȳ�ͬ��Kֵ��ͬ����C����
D���¶�Խ�ߣ�ѹǿԽ������3�Ǿ��ȣ���Ӧ�Ƿ��ȷ�Ӧ��P3��P1����D��ȷ��
�ʴ�Ϊ��AD��
(4)����ͼ��֪��6min�Ժ�CO��Ũ������CO2Ũ�ȼ�С��˵��ƽ�������ƶ���ע������Ũ��û��ͻԽ�Ա仯��˵���ı�����������£�
����ͼ��֪����ǰ�������Ϊ5L�������������10L��Ũ�ȱ�Ϊ��ǰһ�룬�൱�ڼ�Сѹǿ���÷�Ӧ�������������ķ�Ӧ����Сѹǿ��ƽ�ⲻ�ƶ�����6��10minCO2�����ʵ���Ũ����ʱ��仯������Ϊ ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ�ת����ϵ��ͼ��ʾ�����ַ�Ӧ������·ȥ����A���Ϻ�ɫ�Ľ������ʣ�BΪǿ�ᣬE�ڳ�����Ϊ��ɫҺ�壬D��F��GΪ���塣��ش��������⣺
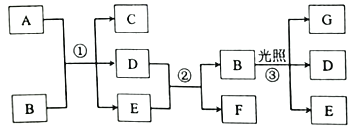
��1��G�Ļ�ѧʽΪ___��ʵ�������Լ�BӦ������___�С�
��2��д����Ӧ�ٵĻ�ѧ����ʽ��___����Ӧ��B���ֵ�����Ϊ___��
��3��д����Ӧ�ڵ����˷���ʽ��___��ʵ������F����___���ռ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�һ�����ܱ������У�����һ������NO(g)������C(s)��������ӦC(s)��2NO(g) ![]() CO2(g)��N2(g)��ƽ��״̬ʱNO(g)�����ʵ���Ũ��[NO]���¶�T�Ĺ�ϵ��ͼ��ʾ��������˵������ȷ����(����)
CO2(g)��N2(g)��ƽ��״̬ʱNO(g)�����ʵ���Ũ��[NO]���¶�T�Ĺ�ϵ��ͼ��ʾ��������˵������ȷ����(����)

A. �÷�Ӧ����H>0
B. ���÷�Ӧ��T1��T2ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1<K2
C. ��T2ʱ������Ӧ��ϵ����״̬D�����ʱһ����v��<v��
D. ��T3ʱ�������������ܶȲ��ٱ仯��������жϷ�Ӧ�ﵽƽ��״̬C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��д�����������Լ����������������������ʣ�
���屽���壩 �Լ�__________������_____��
�����飨��ϩ���Լ�___������____��
��2��ij�л���Ľṹ��ʽ��ͼ��ʾ���������ʵ����ĸ��л���ֱ�������Na��NaOH��NaHCO3ǡ�÷�Ӧʱ��������Na��NaOH��NaHCO3�����ʵ���֮����__________��
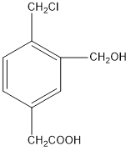
��3���л���Aֻ����C��H��O����Ԫ�أ��������л��ϳɵ��м��塣 16.8 g���л��ᆳȼ������44.0 gCO2��14.4 gH2O������ͼ��������Է�������Ϊ84���������������A�����к���-O-H����λ�ڷ��Ӷ˵�-C��C-�����˴Ź��������������壬�������Ϊ6:1:1��
��A�ķ���ʽ��______ �� A�Ľṹ��ʽ��_______��
���л���B��A��ͬ���칹�壬1 mol B����1mol Br2�ӳɡ����л�������̼ԭ����ͬһ��ƽ�棬û��˳���칹����B�Ľṹ��ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�����ij������ʱ�������ж��ò�ʵ���������ɡ�����ʵ���г��ֽ����ò�������������ȷ����
A.����п��Ƥп�Ʋ��ȵIJⶨ������Ƥ��ϡ������Һ�в��ٲ�������
B.��ʳ�����Ậ���IJⶨ��������NaOH����Һ����ƿ����Һǡ�ó�dz��ɫ
C.��������������������ˮ������NaOH��Һ�ϲ���Ͳ���ʧ
D.����������淋��Ʊ���������![]() ��
��![]() �����Һ�����ִ�������
�����Һ�����ִ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�������![]() ��һ����Ҫ�Ĺ�ҵԭ�ϣ���ҵ�ϳ��ø�����
��һ����Ҫ�Ĺ�ҵԭ�ϣ���ҵ�ϳ��ø�����![]() ���Ʊ���ʵ�������Ժ췯��
���Ʊ���ʵ�������Ժ췯��![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ�![]() ���������£�
���������£�
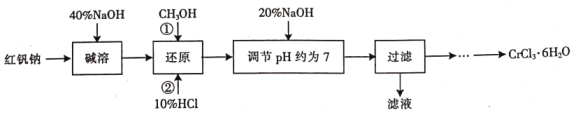
��֪����![]() ��
��
��![]() ���������ѣ�������ˮ���Ҵ�����ˮ�⣻
���������ѣ�������ˮ���Ҵ�����ˮ�⣻
�ۼ״�����ɫҺ�壬�ж����е�64.7����ȼ��
��ش�
(1)���ܵ�Ŀ����________________��
(2)��ԭʱ�ȼ������![]() �ټ���10%HCl������
�ټ���10%HCl������![]() ���÷�Ӧ�����ӷ���ʽΪ________________��
���÷�Ӧ�����ӷ���ʽΪ________________��
(3)��������Һ�з����![]() ѭ��ʹ�á�
ѭ��ʹ�á�
�������й�����ʵ��˵����ȷ����_________(�����)��
A.����ʼ��Ӧ�ȼ�����ͨ����ˮ
B.ͨ������ɳ�ȥҺ�����ѻӷ��ӷ�������
C.���¶ȼƲ�����Һ�У�����ռ����е�ƫ�ߵ�����
D.������е���ߵijɷ�ʱ��Ӧ�ÿ�������
��ʵ���������ͼװ�ý�������װ���д��ڵĴ�����_________��
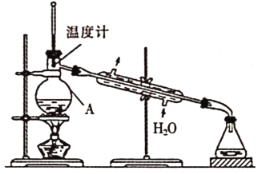
���ڸ������װ���У�������A�м����ʯ���ټ�����Һ�������ռ��������![]() ���е�ͬѧ��Ϊ���ù�������Ҫ����CaO����ֹˮ��
���е�ͬѧ��Ϊ���ù�������Ҫ����CaO����ֹˮ��![]() һ������������Ϊ�Ƿ��б�Ҫ��˵�����ɣ�_______��
һ������������Ϊ�Ƿ��б�Ҫ��˵�����ɣ�_______��
(4)�벹�������ɹ��˺�õ��Ĺ���![]() �Ʊ�
�Ʊ�![]() ��ʵ�鷽��(�ɹ�ѡ����Լ������ᡢ���ᡢ����ˮ���Ҵ�������)�������˺����ù���__________��__________����ȴ�ᾧ�����ˣ�__________�����¸���õ�
��ʵ�鷽��(�ɹ�ѡ����Լ������ᡢ���ᡢ����ˮ���Ҵ�������)�������˺����ù���__________��__________����ȴ�ᾧ�����ˣ�__________�����¸���õ�![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��Na2CO3����0.10 mol��L-1Na2CO3��Һ�Ĺ�������ͼ��ʾ������Ϊ��ͬѧ�Ĵ����У� ��
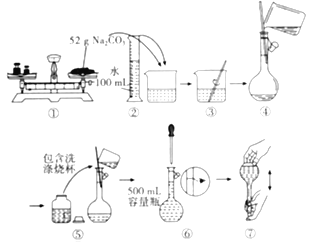
A.�٢ݢ�B.�ڢܢ�
C.�٢�D.�ݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧӦ�ù㷺����ش��������⣺
��1���Է����е�������ԭ��Ӧ������Ƴ�ԭ��ء�����طŵ�ʱ�ķ�ӦʽΪ��2Cu��2H2SO4��O2= 2CuSO4��2H2O���õ�صĸ�������Ϊ_________�������ĵ缫��ӦʽΪ__________________��
��2��ȼ�ϵ�غͶ��ε�ص�Ӧ�÷dz��㷺��
����ͼΪ����ȼ�ϵ�ص�ʾ��ͼ����ع���ʱ��b���ĵ缫����Ϊ_______�������ĵ缫��ӦʽΪ____________��

��Ǧ����Ϊ�����г��õĶ��ε�ء��ŵ�ʱ�ķ�ӦΪ��PbO2 + Pb+ ��H2SO4 === PbSO4 + 2H2O��Ǧ���ظ����ĵ缫��ӦʽΪ__________�����ʱ��Ǧ���ص�PbO2��Ӧ�����ֱ����Դ��__��������PbO2���ĵ缫��ӦʽΪ_________��
��3����Ǧ����Ϊ��Դ������ͭ(��Fe��Pb��Ag��Au����������Ӧ��)ʱ��������ͭ��ҺΪ�������Һ����ͭ��_____��������һ��ʱ�����������128 gʱ��Ǧ���زμӷ�Ӧ����������ʵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Cl2����ͨ��ˮ�������ͣ�Ȼ�������ñ�����ˮ�еμ�0.10 mol��L��1��NaOH��Һ��������������ҺpH�仯��������ͼ��ʾ��������������ȷ����

A. �����ʾ��Һ�У�c(H+)=c(Cl��)+c(HClO)+c(OH��)
B. �����ʾ��Һ�У�c(H+)��c(Cl��)��c(ClO��)��c(HClO)
C. �����ʾ��Һ�У�c(Na+)=2c(ClO��)+c(HClO)
D. �����ʾ��Һ�У�c(Na+)>c(ClO��)>c(Cl��)>c(HClO)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com