
【题目】反应4NH3+5O2=4NO+6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mo1,则此反应的平均速率Vx为( )
A. VO2=0.01mo1L-1s-1B. VNO=0.008mo1L-1s-1
C. VH2O=0.002mo1L-1s-1D. VNH3=0.002mo1L-1s-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示,从A处通入新制备的Cl2,关闭B阀时,C处的红色布条看不到明显现象;当打开B阀后,C处红色布条逐渐褪色。D瓶中装的是( )

①浓硫酸 ②NaOH溶液 ③H2O ④饱和NaCl溶液
A. ①③ B. ②④ C. ①② D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对二乙烯苯(如图)可用作树脂、油漆及特种橡胶的原料。下列说法正确的是
![]()
A.分子中所有原子可能共平面B.易溶于甲苯,沸点比甲苯低
C.不能使稀酸性高锰酸钾溶液褪色D.1 mol该物质至多可与2 mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组模拟其合成方法如图:
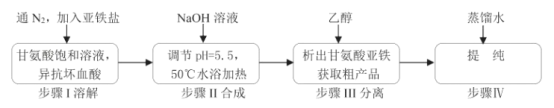
已知:

请回答:
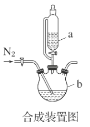
(1)合成装置中仪器b的名称是___。
(2)合成过程中,本实验为了防止Fe2+被氧化,采取的措施是___。
(3)写出水浴加热过程中生成甘氨酸亚铁络合物的离子方程式___。
(4)下列说法正确的是___。
A.滴入液体前,应先打开滴液漏斗a的上口玻璃塞
B.根据题中所给信息,亚铁盐应选用FeSO4·7H2O
C.步骤Ⅲ中的分离方法是过滤
D.步骤IV,提纯操作中的干燥过程最好选用真空干燥
(5)合成过程需控制pH=5.5,试说明理由___。
(6)步骤Ⅲ加入无水乙醇的目的是___。
(7)若甘氨酸的投料量为300kg,得到纯品344.8kg,则产品的产率为___ %(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第五周期IIA族元素,其化合物六水氯化锶(SrCl26H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如图:
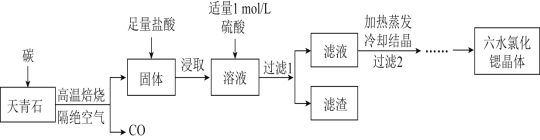
已知:①经盐酸浸取后的溶液中除含有Sr2+和Cl-外,还有少量的Ba2+杂质。
②BaSO4的溶度积常数为1.1×10-10,SrSO4的溶度积常数为3.3×10-7。
③SrCl26H2O的摩尔质量为267g/mol。
(1)工业上天青石焙烧前应先研磨粉碎,其目的是__。
(2)工业上天青石隔绝空气高温焙烧时,若0.5molSrSO4中只有S元素被还原,且转移了4mol电子。则该反应的化学方程式为__。
(3)浸取后加入硫酸的目的是 用离子方程式表示 __。为了提高原料的利用率,滤液中Sr2+的浓度应不高于__mol/L。
(注:此时滤液中Ba2+浓度为1.0×10-5mol/L)。
(4)产品纯度检测:称取1.000g产品溶解于适量水中,向其中加入含AgNO30.01mol的AgNO3溶液。溶液中除Cl-外,不含其它与Ag+反应的离子 ,待Cl-完全沉淀后,滴入1—2滴含Fe3+的溶液作指示剂,用0.2000mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。已知:SCN-先与Ag+反应。
①滴定反应达到终点的现象是__。
②若滴定过程用去上述浓度的NH4SCN溶液20.00mL,则产品中SrCl26H2O的质量百分含量为___(保留3位有效数字)。
(5)由SrCl26H2O晶体制取无水氯化锶的主要仪器除了酒精灯、泥三角、三脚架外,还有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
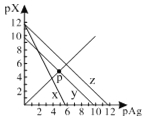
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若反应2NO(g)+O2(g)![]() 2NO2的平衡常数为K1,2NO2(g)
2NO2的平衡常数为K1,2NO2(g)![]() N2O4(g)的平衡常数为K2,则反应2NO(g)+O2(g)
N2O4(g)的平衡常数为K2,则反应2NO(g)+O2(g)![]() N2O4(g)的平衡常数K=___。
N2O4(g)的平衡常数K=___。
(2)25℃、101KPa时,1Kg乙醇充分燃烧后放出的热量为29714kJ,则乙醇的燃烧热△H=__。
(3)反应mA+nB![]() pC在某温度下达到平衡。
pC在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关是___。
②若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向___方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为__态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的转化关系如图所示(部分反应条件己路去)。A是紫红色的金属单质,B为强酸,E在常温下为无色液体,D、F、G为气体。请回答下列问题:
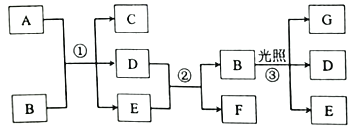
(1)G的化学式为___,实验室中试剂B应保存在___中。
(2)写出反应①的化学方程式:___,反应中B体现的性质为___。
(3)写出反应②的离了方程式:___,实验室中F可用___法收集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com