
【题目】在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?) xC(g)△H<0,平衡时M中A、B、C的物质的量之比为1:3:4。下列判断不正确的是( )
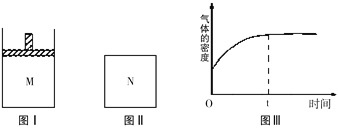
A、x=2
B、若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C、A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D、若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
【答案】D
【解析】
试题分析:A、设达平衡后B的物质的量减少nmol,则A的物质的量减少2nmol,C的物质的量增加xnmol,平衡时A、B、C的物质的量分别是(mol):a-2n、a-n、xn,所以(a-2n):(a-n)=1:3,解得n=0.4a,(a-2n):(xn)=1:4,x=2,正确;B、N是恒温恒容条件,由图III可知,气体的密度逐渐增大,说明气体的质量逐渐增加,若A、B都是气体,则混合气体的密度会一直不变,所以A、B中只有一种是气态,B正确;C、A为气体,B为非气体,则该反应是反应前后气体物质的量不变的可逆反应,恒温恒压与恒温恒容达到的平衡是等效的,所以平衡时M、N中C的物质的量相等,C正确;D、若A、B均为气体,M平衡后的容器的压强大于N容器,所以由M容器得到N容器的平衡状态,需要减小压强,平衡逆向移动,M中A的转化率减小后与N中A的转化率相同,所以原平衡时M中A的转化率大于N中A的转化率,D错误,答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在pH=1的溶液中,下列离子组能大量共存且溶液为无色透明的是C
A.Na+、K+、OH-、Cl-
B.Na+、Cu2+ 、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl-
D.Ba2+、HCO3-、NO3-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干空气中稳定,在湿空气中分解,是无机合成和有机合成中常用的选择性还原剂。某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:

下列说法不正确的是
A.实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀
B.操作②、操作③分别是过滤与蒸发结晶
C.反应①加料之前需将反应器加热至100℃以上并通入氩气
D.反应①中氧化剂与还原剂的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.元素的种类由最外层电子数决定
B.化学键是存在于分子、原子和离子间的作用力
C.原子的种类由原子核内质子数与中子数共同决定
D.化学反应速率可以决定反应的限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
A. 配制标准溶液的固体KOH中混有NaOH杂质
B. 滴定到终点读数时,仰视滴定管的刻度,其他操作正确
C. 盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D. 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 在过氧化钠与水的反应中,固体每增重mg,转移电子的数目为mNA
B. 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C. 已知反应: 2NH3+NO+NO2=2N2+3H2O,每生成2mol N2转移的电子数目为6NA
D. 标准状况下,1 mol CCl4的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol/L的一元碱BOH与等浓度盐酸等体积混合后,所得溶液中部分微粒组分及浓度如图所示。下列说法正确的是( )
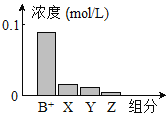
A.BOH为强碱
B.该混合液pH=7
C.该混合溶液中:c(B+)+c(Y)=c(Cl-)
D.图中X表示BOH,Y表示H+,Z表示OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com