
| A. | 己烷、己烯和CCl4可以用溴水鉴别 | |
| B. | 除去甲苯中的苯乙烯(C6H5CH═CH2)可以用溴水 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | 乙烯和二氧化硫使溴水褪色的原理相同 |
分析 A.四氯化碳的密度比水大,己烷的密度比水小,己烯含有C=C,能与溴水发生加成反应而使溴水褪色;
B.苯乙烯与溴水的加成产物与苯混溶;
C.聚氯乙烯和苯不含碳碳双键;
D.乙烯含有碳碳双键,可发生加成反应,二氧化硫与溴水发生氧化还原反应.
解答 解:A.四氯化碳、己烷都不溶于水,但四氯化碳的密度比水大,己烷的密度比水小,己烯含有C=C,能与溴水发生加成反应而使溴水褪色,可鉴别,故A正确;
B.苯乙烯与溴水发生加成生成二溴乙苯,与苯混溶,不能得到纯净的苯,应加入高锰酸钾氧化,反应后加入氢氧化钠溶液分层,故B错误;
C.聚氯乙烯和苯不含碳碳双键,故C错误;
D.乙烯含有碳碳双键,可发生加成反应,二氧化硫与溴水发生氧化还原反应,反应原理不同,故D错误.
故选A.
点评 本题考查有机物的结构与性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物中的官能团,熟悉烯烃、苯的性质即可解答,注重基础知识的考查,题目难度不大.


 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.0mol•L-1 | B. | 0.10mol•L-1 | C. | 1.0mol•L-1 | D. | 0.50mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
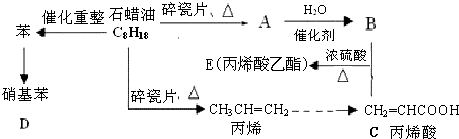
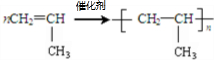 ;反应类型加聚反应.
;反应类型加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X中肯定有碳碳双键 | |
| B. | X中可能有三个羟基和一个 一COOR官能团 | |
| C. | X中可能有三个羧基 | |
| D. | X中可能有两个羧基和一个羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 金属 | 电压表指针偏转方向 | 电压/V |
| Al | 指向Cu | +0.78 |
| 甲 | 指向甲 | -0.15 |
| 乙 | 指向Cu | +1.35 |
| Fe | 指向Cu | +0.30 |
| 丙 | 指向Cu | +0.45 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
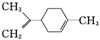 所示.有关柠檬烯的分析正确的是( )
所示.有关柠檬烯的分析正确的是( )| A. | 它的一氯代物有6种 | |
| B. | 一定条件下,它分别可以发生加成、取代、氧化等反应 | |
| C. | 它的分子中所有的碳原子可能在同一平面上 | |
| D. | 它和丁基苯(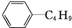 )互为同分异构体 )互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com