
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
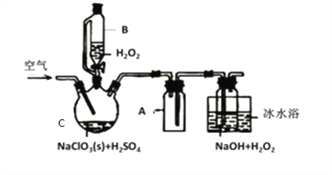
(1)仪器C的名称是__________________,仪器A的作用是_________________,冰水浴冷却的目的是_____________________和___________________________。
(2)该装置不完善的方面是________________________。
(3)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,___________;空气流速过快时,________________。
(4)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①_____________________________(用离子方程式表示)
②H2O2+Cl2=2Cl-+O2+2H+
(5)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为_________________。(M(NaClO2)=90.5g/mol)
【答案】 三颈烧瓶 防止倒吸 降低NaClO2的溶解度 减少H2O2的分解、增加ClO2的溶解度、减少ClO2的分解 没有尾气处理装置 空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解 空气流速过快时,ClO2不能被充分吸收,导致浪费原料,产率降低 2ClO3-+2Cl-+4H+=2C1O2↑+Cl2↑+2H2O 当最后一滴滴定液滴下后,溶液由蓝色变无色,且30秒内不恢复 90.5%
【解析】(1)仪器C的名称是三颈烧瓶;仪器A为安全瓶,可以防止倒吸;双氧水易分解,ClO2浓度过高时易发生分解,因此冰水浴冷却的目的是为降低NaClO2的溶解度,减少H2O2的分解,增加ClO2的溶解度,减少ClO2的分解。答案为:三颈烧瓶;防止倒吸;降低NaClO2的溶解度 ;减少H2O2的分解、增加ClO2的溶解度、减少ClO2的分解
(2)ClO2有毒,污染空气,应该做尾气处理,该装置没有尾气处理装置。答案为:没有尾气处理装置
(3)空气流速过慢时,ClO2不能及时被移走,浓度过高导致ClO2分解;空气流速过快时,ClO2不能被充分吸收,因此空气流速过快或过慢,均降低NaClO2产率。答案为:空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解;空气流速过快时,ClO2不能被充分吸收,导致浪费原料,产率降低
(4)Cl-存在时会催化ClO2的生成,根据第二步反应可知产生氯离子,因此第一步是消耗氯离子,离子方程式为2ClO3-+2Cl-+4H+=2C1O2↑+Cl2↑+2H2O 。答案为:2ClO3-+2Cl-+4H+=2C1O2↑+Cl2↑+2H2O
(5)②有碘单质参与的反应一般采用淀粉溶液为指示剂,因此现象为:当最后一滴滴定液滴下后,溶液由无色变蓝色,且30秒内不褪色。NaClO2和碘化钾反应的离子方程式为ClO2-+4 I-+4 H+= Cl-+2I2+2 H2O根据方程式可以找出一个对应关系即:ClO2-─2I2─4 S2O32-,因为20ml的Na2S2O3溶液中Na2S2O3的物质的量为0.04mol,所以ClO2-的物质的量为![]() ,NaClO2的质量为0.1mol×90.5g/mol=9.05g,故NaClO2的质量分数为
,NaClO2的质量为0.1mol×90.5g/mol=9.05g,故NaClO2的质量分数为![]() .答案为:当最后一滴滴定液滴下后,溶液由蓝色变无色,且30秒内不恢复 ,90.5%
.答案为:当最后一滴滴定液滴下后,溶液由蓝色变无色,且30秒内不恢复 ,90.5%


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况),原混合物质量可能是( )
A. 2g B. 4g C. 10g D. 12g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“一”相连的两种物质能发生反应)。下列判断正确的是
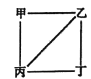
A. X是元素周期表中非金属性最强的元素
B. Z冶炼可通过电解其氯化物的方式获得
C. 4种原子中,Y离子半径最小
D. W的阴离子可能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾(CuSO4·5H2O)有广泛的用途。某研究性学习小组利用某次实验后的稀硫酸、稀硝酸混合液制备胆矾。实验流程如下:
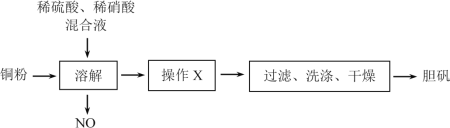
请回答下列问题:
(1)操作X为___,___。
(2)NO需要回收利用,写出NO与空气、H2O反应生成硝酸的化学方程式___。
(3)现有48g含CuO质量分数为20%的铜粉,与一定量的稀硫酸、稀硝酸混合液恰好完全反应生成CuSO4。试求:
①理论上生成胆矾的质量为___g。
②原混合液中硫酸和硝酸的物质的量之比。___(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)金属钠是一种非常活泼的金属,通常保存________中。把钠投入硫酸铜溶液中,发生反应的离子方程式为__________、_______。
(2)有一透明溶液,可能含有![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 等离子中的一种或几种。现加入
等离子中的一种或几种。现加入![]() 粉末有无色无味的气体放出,同时析出白色沉淀。假设溶液中的水足量,加入
粉末有无色无味的气体放出,同时析出白色沉淀。假设溶液中的水足量,加入![]() 的量与生成白色沉淀的量之间的关系如图来表示。试推断:
的量与生成白色沉淀的量之间的关系如图来表示。试推断:
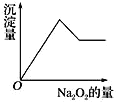
①原溶液中一定含有的离子是_________________;
②一定不含有的离子是________________;
③可能含有__________;为了进一步确定可能含有该离子,可增加焰色反应的实验,透过蓝色钴玻璃观察到的火焰的颜色为______色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A含有![]() 、
、![]() 和
和![]() ,在一定条件下可实现如图所示的物质之间的变化:
,在一定条件下可实现如图所示的物质之间的变化:
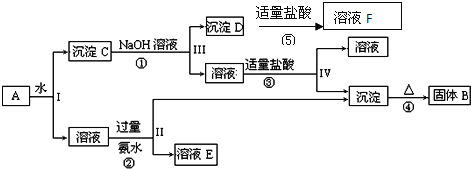
据此回答下列问题:
![]() 、II、III、IV四步中对于溶液和沉淀的分离采取的方法是______.
、II、III、IV四步中对于溶液和沉淀的分离采取的方法是______.
![]() 根据上述框图反应关系,写出下列B、D所含物质的化学式固体B______;沉淀D______;
根据上述框图反应关系,写出下列B、D所含物质的化学式固体B______;沉淀D______;
![]() 写出
写出![]() 的化学方程式 _____________;
的化学方程式 _____________;
![]() 写出
写出![]() 、
、![]() 两个反应的离子方程式
两个反应的离子方程式![]() ___________________;
___________________;![]() _______________;
_______________;
(5)写出![]() 在工业上的一种主要用途:_________________。
在工业上的一种主要用途:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某矿物固体X(仅含4种短周期元素)的组成和性质,其中固体乙可制光导纤维。现设计并完成如下实验:

请回答:
(1)X除了含有H、O元素以外还含有____________。
(2)固体丙的用途____________。
(3)X的化学式是____________。
(4)固体乙与NaOH溶液反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,金属钠和CO2可制得金刚石:4Na+3CO2![]() 2Na2CO3+C(s,金刚石)
2Na2CO3+C(s,金刚石)
完成下列填空:
(1)上述反应中涉及的元素的原子半径从大到小的顺序为____。
(2)能证明碳元素与氧元素非金属强弱的事实是___(选填编号)。
a.最高价氧化物水化物的酸性 b.两种元素的气态氢化物的沸点
c.CO2中元素的化合价 d.气体氢化物受热分解的温度
(3)高压下,科学家成功地将CO2转化为具有类似SiO2结构的原子晶体,比较SiO2与CO2这两种原子晶体的熔沸点高低,并说明理由:___。
常压 | 熔点(℃) | 沸点(℃) |
钠 | 97.8 | 882.9 |
Na2CO3 | 851 | 1850分解 |
金刚石 | 3550 | … |
石墨 | 3850 | 4250 |
(4)若在2L密闭容器中,10min内金属钠减少了0.2mol,则CO2的平均反应速率为___。该反应在常压1000℃下进行,根据右表数据,该反应的平衡常数表达式K=___。
(5)若在2L密闭容器中,常压、1000℃下,起始时,下列物理量能说明该反应已达到平衡状态的是____。
a.气体的平均摩尔质量不变 b.3v消耗(Na)=4v生成(CO2)
c.气体的密度不变 d.![]() 的比值不变
的比值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种化合物均由短周期元素组成。其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如下图转化关系(部分反应物、产物及反应条件已略去)。请回答:
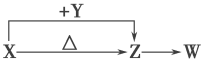
(1)Y的电子式是____________________。
(2)X与Y在溶液中反应的离子方程式是__________________________________________。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
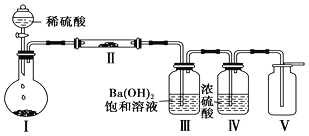
①装置Ⅰ中反应的化学方程式是_________________________________________________,装置Ⅱ中反应的化学方程式是________________________________________________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是___________,所需仪器装置是_______________。 (从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com