

分析 (1)根据图1知,食盐水一次精制时需要烧碱和纯碱,阴极时得到NaOH;用食盐水精制后然后电解得到氯气、氢气和烧碱,阳极液通过脱氧得到食盐水,据此判断循环利用的物质;
(2)除去钙离子使用碳酸钠试剂,除去镁离子使用氢氧化钠试剂,根据处理后的盐水中还含有少量杂质离子对装置的影响角度来回答;
(3)电解池中,阳离子移向阴极,根据电极反应确定产物,根据电解池的工作原理来书写方程式;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠;
(5)计算生成NaOH的质量,根据理论耗电量和实际耗电量计算.
解答 解:(1)根据图1知,食盐水一次精制时需要烧碱和纯碱,阴极时得到NaOH;用食盐水精制后然后电解得到氯气、氢气和烧碱,阳极液通过脱氧得到食盐水,据此判断循环利用的物质是氯化钠、氢氧化钠,故答案为:氯化钠、氢氧化钠;
(2)除去钙离子使用碳酸钠试剂,Ca2++CO32-=CaCO3↓除去镁离子使用氢氧化钠试剂,Mg2++2OH-=Mg(OH)2↓,处理后的盐水中还含有少量杂质离子Mg2+、Ca2+,碱性条件下会生成沉淀,对装置中的交换膜产生影响,
故答案为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓;少量Mg2+、Ca2+在电解碱性条件下会生成沉淀,损害离子交换膜;
(3)电解池中,阳离子钠离子移向阴极,所以B是电源的负极,A是正极,E是阳极,在阴极上产生的是氢气,电解饱和食盐水的原理方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,故答案为:H2;阳极;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠,即SO32-+Cl2+H2O═SO42-+2H++2Cl-,故答案为:SO32-+Cl2+H2O═SO42-+2H++2Cl-;
(5)烧碱溶液质量为1.342×103kg/m3×113m3=1.516×105kg,
m(NaOH)=1.516×105kg×32%=4.85×104kg,
则理论上需要电流量为$\frac{4.85×1{0}^{7}g}{1.492g}$=3.252×107A,
则实际上耗电量为1.45×104A×8×300=3.48×107A,
该电解槽的电解效率为$\frac{3.252}{3.48}$×100%=93.45%,
故答案为:93.45%.
点评 本题考查氯碱工业,侧重考查学生电解原理、有关计算、氧化还原反应等知识点,明确各个电极上发生的反应,难点是离子方程式的书写,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 若Q、M为烯烃,则N可以使溴的CCl4溶液褪色 | |
| B. | 若Q、M均为一元羧酸,则N的分子式可能是CH2O2 | |
| C. | 三种物质的组成元素相同,相对分子质量相同 | |
| D. | 三种物质的分子结构相似,分子组成相差若干个“CH2”基团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得0.20mol NaCl和0.08mol NaHCO3 | |
| B. | 剩0.04mol Na2CO3,得0.20mol NaCl | |
| C. | 剩0.06mol HCl,得0.14mol NaCl和0.14mol NaHCO3 | |
| D. | 得0.06mol NaCl和0.08mol NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z 元素的气态氢化物的热稳定性均依次递减 | |
| B. | Y、Z、W 元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | 液态WX3 气化均需克服分子间作用力 | |
| D. | 根据元素周期律,可以推测T 元素的单质具有半导体的特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 小苏打长期放置在空气中会变质(部分转变为Na2CO3),某研究小组欲测定某小苏打样品中NaHCO3的质量分数,设计如下实验方案:
小苏打长期放置在空气中会变质(部分转变为Na2CO3),某研究小组欲测定某小苏打样品中NaHCO3的质量分数,设计如下实验方案:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
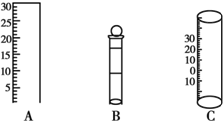 如图所示为中学化学实验中几种常见仪器的部分结构:
如图所示为中学化学实验中几种常见仪器的部分结构:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com