
| A. | HCl | B. | NaHCO3 | C. | 蔗糖 | D. | Na2CO3 |
分析 非电解质、弱电解质溶于水时在水溶液中存在溶质分子,据此分析解答.
解答 解:A.HCl是强电解质,在水溶液中完全电离生成阴阳离子,则溶液中不存在溶质分子,故A不选;
B.碳酸氢钠是强电解质,在水溶液中完全电离生成阴阳离子,则溶液中不存在溶质分子,故B不选;
C.蔗糖是非电解质,在水溶液中以分子存在,所以其水溶液中存在溶质分子,故C选;
D.碳酸钠是可溶性强电解质,在水溶液中完全电离生成阴阳离子,则溶液中不存在溶质分子,故D不选;
故选C.
点评 本题考查电解质的电离,为高频考点,明确电解质和非电解质概念内涵及其区别、强弱电解质概念及其区别是解本题关键,注意碳酸氢钠在水溶液中完全电离生成金属阳离子和酸式酸根离子离子,题目难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:实验题
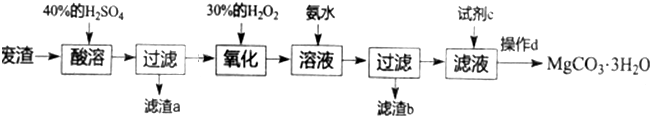
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
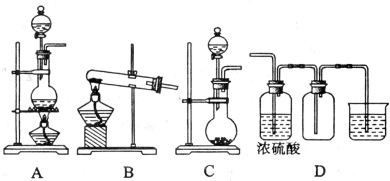
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
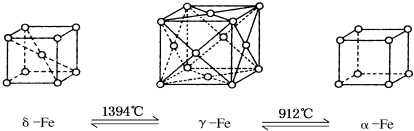
| A. | 将铁加热到1500°C分别急速冷却和缓慢冷却,得到的晶体类型相同 | |
| B. | α-Fe晶体中与每个铁原子等距离且最近的铁原子有6个 | |
| C. | 若δ-Fe晶胞边长为a cm,α-Fe晶胞边长为b cm,则两种晶体密度比为2b3:a3 | |
| D. | δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XCl | B. | XCl2 | C. | XCl3 | D. | XCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -1648.8KJ/mol | B. | -824.4KJ/mol | C. | +1648.8KJ/mol | D. | -744.7KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
; ;A、B、E形成的化合物
;A、B、E形成的化合物 ;D、E形成的化合物
;D、E形成的化合物 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com