
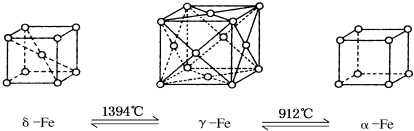
| A. | 将铁加热到1500°C分别急速冷却和缓慢冷却,得到的晶体类型相同 | |
| B. | α-Fe晶体中与每个铁原子等距离且最近的铁原子有6个 | |
| C. | 若δ-Fe晶胞边长为a cm,α-Fe晶胞边长为b cm,则两种晶体密度比为2b3:a3 | |
| D. | δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个 |
分析 A.将铁加热到1500℃分别急速冷却和缓慢冷却,温度不同,分别得到α-Fe、γ-Fe、δ-Fe,晶体类型不相同;
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子是相邻顶点上铁原子,铁原子个数=2×3=6,据此判断;
C.若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体中铁原子个数之比=(1+$8×\frac{1}{8}$):($8×\frac{1}{8}$)=2:1,密度比=$\frac{\frac{56}{N{\;}_{A}}×2}{{a}^{3}}$:$\frac{\frac{56}{N{\;}_{A}}}{{b}^{3}}$=2b3:a3,据此判断;
D.δ-Fe晶体中,以体心铁原子为例,与之距离相等且最近的铁原子位晶胞的8个顶点上,据此判断;
解答 解:A.将铁加热到1500℃分别急速冷却和缓慢冷却,温度不同,得到的晶体类型不相同,故错误;
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子是相邻顶点上铁原子,铁原子个数=2×3=6,故正确;
C.若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体中铁原子个数之比=(1+$8×\frac{1}{8}$):($8×\frac{1}{8}$)=2:1,密度比=$\frac{\frac{56}{N{\;}_{A}}×2}{{a}^{3}}$:$\frac{\frac{56}{N{\;}_{A}}}{{b}^{3}}$=2b3:a3,故正确;
D.δ-Fe晶体中,以体心铁原子为例,与之距离相等且最近的铁原子位晶胞的8个顶点上,故正确;
故选A.
点评 本题考查了晶胞的结构、反应条件、不同类型的晶体的性质等知识,中等难度,注重基础知识的运用.


科目:高中化学 来源: 题型:选择题
| A. | 23g/L | B. | 27.2g/L | C. | 29.25g/L | D. | 32.4g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 酸 | HM | HN | HR |
| 电离常数 K | 9×10-7 | 9×10-6 | 10-2 |
| A. | 三种酸的强弱关系:HM>HN>HR | |
| B. | 反应 HR+N-═HN+R-能够发生 | |
| C. | 相同温度下,0.1 mol/L 的 HM、HN、HR 溶液,HM 溶液 pH 最大 | |
| D. | 相同温度下,1 mol/L HM 溶液的电离常数大于 0.1 mol/L HM |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周 期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | i | |
| 4 | j | k |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 | |
| B. | 将一块未擦去氧化膜的铝片分别投入1 mol•L-1 CuSO4溶液中,铝片表面观察不到明显的反应现象 | |
| C. | 制取摩尔盐时和制取阿司匹林时都可用酒精洗涤产品 | |
| D. | 在AlCl3溶液中先滴加足量的NH4F溶液,在滴加氨水,将看不到溶液变浑浊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com