
 )是运载火箭的主体燃料.与偏二甲肼分子式相同,分子中含碳碳单键的同分异构体共有( )
)是运载火箭的主体燃料.与偏二甲肼分子式相同,分子中含碳碳单键的同分异构体共有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
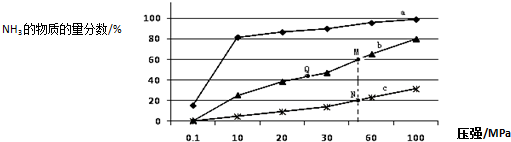
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2N02(g)═N2(g)+C02(g)+2H2O(l)△H=-867 kJ.mol-1 | |
| B. | CH4催化还原1molNOx为N2的过程中,若x=1.5,则转移的电子总数为3×6.02×1021 | |
| C. | 若0.2 mol CH4还原N02至N2,在上述条件下吸收眵热迸为173.4 kJ | |
| D. | 若用4.48 LCH4还原N02至N2,整个过程中转移电子总数为1.6×6.02×1021 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
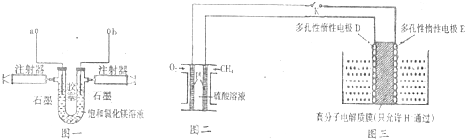
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的结构简式:C2H6O | B. | 丙烷分子的球棍模型示意图: | ||
| C. | 芳香烃的组成通式:CnH2n-6(n≥6) | D. | 乙炔的最简式:CH≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
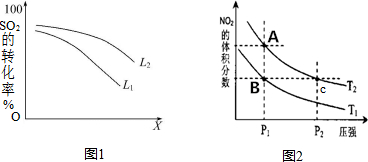
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com